以下是25℃时几种难溶电解质的溶解度:
| 难溶电解质 |
Mg(OH) 2 |
Cu(OH) 2 |
Fe(OH) 2 |
Fe(OH) 3 |
| 溶解度/g |
9×10-4 |
1.7×10-6 |
1.5×10-4 |
3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子,例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe3+、Fe2+都被转化为____________(填化学式)而除去.
(2)①中加入的试剂应该选择________为宜,其原因是_________________.
(3)②中除去Fe3+所发生的总反应的离子方程式为_____________________.
(4)下列与方案③相关的叙述中,正确的是________(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
按要求完成下列问题:
(1) 的名称_________________。
的名称_________________。
(2)4―甲基―2―戊烯的键线式为_________________。
(3)写出乙醛与新制氢氧化铜反应化学方程式_________________。
(4)苯的硝化反应方程式_________________。
(5)硬脂酸甘油酯在NaOH溶液中的皂化反应方程式_________________。
有机物A是一种纯净的无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实验步骤 |
解释或实验结论 |
| (1)称取A物质 18.0 g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: (1)A的相对分子质量为:________ |
(2)A的核磁共振氢谱如下图: |
(2)A中含有______种氢原子 |
| (3)另取A 18.0 g与足量的NaHCO3粉末反应,生成0.2 mol CO2,若与足量钠反应则生成0.2 mol H2。 |
(3)写出A中所含官能团的名称: |
| (4)将此18.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者依次增重10.8 g和26.4 g。 |
(4)A的分子式为: |
| (5)综上所述A的结构简式____________________。 |
(1)中国古代四大发明之一——黑火药,它的爆炸反应为
2KNO3+3C+S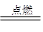 A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
①在生成物中,A的晶体类型为,含极性共价键的分子的中心原子轨道杂化类型为。
②除S外,上列元素的电负性从大到小依次为。
(2)①已知CN—与N2结构相似,推算HCN分子中 键与
键与 键数目之比为。
键数目之比为。
②原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为,Q2+的未成对电子数是。
③在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:[CrCln(H2O)6-n]x++xR—H→Rx[CrCln(H2O)6-n]+xH+
交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成。 将含0.0015 mol [CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1 NaOH溶液25.00 ml,该配离子的化学式为。
(14分) A、B、C、D、E是原子序数依次增大的短周期主族元素,A、D在周期表中的相对位置如下表;A元素最低负化合价的绝对值与其原子最外层电子数相等;C是地壳中含量最多的金属元素。
| A |
||||
| D |
(1)A与氢元素组成的化合物分子有6个原子,其结构简式为_____________,写出该化合物在常温下使溴水褪色的化学方程式______________________________,该化合物还是一种重要的化工原料,写出其加聚生成高分子的化学方程式:____________________________。
(2)B元素的最高氧化物对应的水化物与它的氢化物反应得到离子化合物,则B元素的单质分子空间构型为___________,写出该单质的一种等电子体:_________________。
(3)C的离子结构示意图为____________,元素E在周期表中的位置是_________________。
(14分)A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大.B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族.B、C、D的最高价氧化物的水化物均能互相反应生成盐和水.A和E可形成离子化合物,其晶胞结构如下图所示: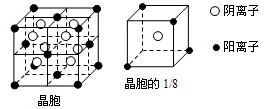
(1)A、C、D、E四种元素依次是____ ____ ____ ____ (用元素符号表示)。
(2)上述四种元素ABCD中第一电离能最小的是________电负性最大的是________其原子半径由小到大的顺序为________________(均用元素符号表示)。
(3)A和D的氢化物中,前者沸点较高,原因是________________________________。
(4)A和E的化合物晶体中,每个阳离子的周围与它最近且等距离的阳离子共有个________。