近来,制备和利用氢气这一清洁能源已有多项成果。
(1)德国克莱斯公司成功研制了甲醇(CH3OH)制氢车载燃料电池工艺,其原理如下流程图所示:

①流程图中,甲醇与水在选择氧化器中反应生成二氧化碳和氢气,写出该反应的化学方程式
②该车载燃料电池的介质为碱性环境,请写出该燃料电池的正极反应式为
(2)美国Bay等工厂成功研制了以甲烷来制取氢气,其生产流程如下图:

①此流程的第Ⅱ步反应为:CO(g)+H2O(g) H2(g)+CO2(g),该反应的化学平衡常数表达式K=
H2(g)+CO2(g),该反应的化学平衡常数表达式K=
②此流程的第Ⅱ步反应的平衡常数随温度的变化如下表,在830 ℃、以表中的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有________(填实验编号)。
| 温度/℃ |
400 |
500 |
830 |
1 000 |
| 平衡常数K |
10 |
9 |
1 |
0.6 |
| 实验编号 |
n(CO) |
n(H2O) |
n(H2) |
n(CO2) |
| A |
1 |
5 |
2 |
3 |
| B |
2 |
2 |
1 |
1 |
| C |
3 |
3 |
0 |
0 |
| D |
0.5 |
2 |
1 |
1 |
③若400 ℃时,第Ⅱ步反应生成1 mol氢气的热效应值为33.2kJ,第Ⅰ步反应的热化学方程式为:CH4(g) + H2O(g) === 3H2(g) + CO(g) ΔH=-103.3 kJ·mol-1则400 ℃时,甲烷和水蒸反应生成二氧化碳和氢气的热化学方程式为:
(3)我国科学家研究了常温下利用Pt等催化剂在可见光作用下使水分解制氢气的方法,下图是三种催化剂在光照分解水实验中的效果比较图。

要得出如图所示的实验结果,需要测定的实验数据是 ,本实验的目的是 。
环己烷()在负载纳米Au的分子筛(Au/TS1)催化剂的作用下与空气发生氧化反应,反应原理是:通过游离基反 应形成环己基过氧化氢,该过氧化物在Au/TS1催化作用下受热分解,生成环己醇和环己酮(O)。由于环己醇、环己酮比环己烷更容易被氧化,因而有许多副产物(如己二酸及一些酯类化合物)生成。
应形成环己基过氧化氢,该过氧化物在Au/TS1催化作用下受热分解,生成环己醇和环己酮(O)。由于环己醇、环己酮比环己烷更容易被氧化,因而有许多副产物(如己二酸及一些酯类化合物)生成。
(1) 下表是某反应温度下,环己烷催化氧化反应的转化率(x)和目标产物的选择性(S)的结果:
| 催化剂 |
转化率(x)/% |
|||
| 目标产物的选择性(S)/% |
||||
| 环己基过氧化氢 |
环己醇 |
环己酮 |
||
| Au/TS1 |
10.4 |
14.1 |
34.9 |
39.8 |
① 写出环己烷催化氧化为环己酮的化学方程式: 。
② 若在反应容器中加入1.0mol环己烷,则生成的环己酮的物质的量为________(保留2位小数)。
(2) 图甲是反应温度对环己烷催化氧化反应的转化率(x)和目标产物的选择性(S)和目标产物的总收率(y)的影响。
① 由图甲可知:该反应较适宜的反应温度为________左右。
② 随着反应温度的升高,环己烷的转化率(x)逐渐增加,而目标产物的选择性(S)和 目标产物的总收率(y)却逐渐降低,其可能的原因是 。
目标产物的总收率(y)却逐渐降低,其可能的原因是 。
(3) 图乙是反应时间对环己烷催化氧化反应的转化率(x)和目标产物的选择性(S)和目标产物的总收率(y)的影响。
① 由图乙可知,该反应较适宜的反应时间为________左右。
② 随着反应时间的延长,环己烷的转化率(x)逐渐增加,而目标产物的选择性(S)逐渐降低,这说明________________________________________________________。
在探索生命奥妙的过程中,科学家们日益认识到生命细胞的组成和元素周期律有密切的关系。已知:①人体中不含稀有气体元素;②约占人体总质量99.97%的11种宏量元素,除K、Ca外,其余都为短周期元素;③其余0.03%是由十多种人体不可缺少的微量元素组成。在微量元素中,只有F和Si位于短周期,其余均在第一长周期。请根据试题要求,在11种宏量元素的8种元素中(除H、N、P外),选择合适元素填空:
(1)有一种元素A,其原子最外层电子数是内层电子数的2倍。则A处于元素周期表的位置为。
(2)有一种元素B,它的最高价氧化物对应的水化物是已知酸中酸性最强的酸,该酸的化学式为。宏量元素C是一种非金属元素,它与B处于同一周期,则C的原子结构示意图为。
(3)所有宏量元素中,元素D金属性最强 ,则D为(填元素符号)。除钙元素外,元素E也与D相邻。则E的单质与水反应的离子方程式为。
,则D为(填元素符号)。除钙元素外,元素E也与D相邻。则E的单质与水反应的离子方程式为。
(4)除A—E和钙元素外,还有两种宏量元素F、G。已知它们的离子的电子层结构相同,且带电量也相同但符号相反。F、G的离子中,半径较大的是(填离子符号)。
一切植物中均含有天然有机高分子化合物A,它是构成植物细胞壁的基础物质,不溶于水,也不溶于一般有机溶剂。能发生如下变化(A-F均分别代表一种物质,框图中的部分产物已略去)
|


图表示由元素周期表中1~20号且不同主族元素组成的单质及化合物之间转化关系(产物中的水已略去)。其中A为单质;在实验室中,常用固体B和固体C加热制取气体F;F与G的组成元素相同,G与I分子所含电子数相同。请回答: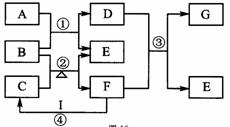
(1)写出B、G的化学式B、G。
(2)写出C的电子式;反应④的实验现象为;写出F的一种具体用
途。
(3)向具有漂白作用的D溶液加入I的稀溶液,写出反应的离子方程式:
。
向D的溶液加入I的浓溶液有A生成,其反应的离子方程式为:
。
(4)写出反应③的化学方程式。
W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水。向该盐的溶液中滴加足量的盐酸,随着盐酸的逐滴加入,所观察到的现象是,反应结束时,该反应的总反应离子方程式为。
(2)W与Y可形成化合物W2Y,该化合物的水溶液显_性,原因(用离子方程式表示)__________________________;它的水溶液中存在多种离子,请写出电荷守恒的等式。
(3)若甲为W的最高价氧化物对应的水化物,乙为Y的氢化物。
现有①0.2mol/甲的溶液和②0.2mol/L乙的溶液,则①中由水电离出c(OH-)
_____②中由水电离出的c(OH-)。(填“>”、“=”或“<”)
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为
。