(1)4g CO 在氧气中燃烧生成 CO2,放出 9.6kJ 热量,写出 CO 燃烧的热化学方程式;
(2)已知拆开 1mol H﹣H 键、1mol N﹣H 键、1mol N≡N 键分别需要的能量是 436kJ、391kJ、946kJ,则 N2与 H2反应生成 NH3的热化学方程式为 。
(3)已知碳的燃烧热△H1="a" kJ•mol﹣1
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H2="b" kJ•mol﹣1
S(s)+2K(s)═K2S(s)△H3="c" kJ•mol﹣1
则 S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H= 。
II.稀土元素是宝贵的战略资源,赣州的稀土蕴藏量居世界首位,是名符其实的稀土王国。
(4)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下 CeCl3易发生水解,无水 CeCl3可用加热 CeCl3·6H2O 和 NH4Cl 固体混合物的方法来制备。其中 NH4Cl 的作用是
(5)在某强酸性混合稀土溶液中加入 H2O2,调节 pH≈3,Ce3+通过下列反应形成 Ce(OH)4沉淀得以分离。完成反应的离子方程式:□Ce3++□H2O2+□H2O ===□Ce(OH)4↓+□_________
(8分)有机物A和B无论以何种比例混合,组成中所含原子核外电子总数均不变。
(1)若A是分子中含8个氢原子的烃,B是分子中含3个碳原子的烃的含氧衍生物。写出两组符合下述条件的有机物的分子式:
①相对分子质量之差为2:A.________B.________。
②相对分子质量相等A.________B.________。
(2)若A是分子中含有4个碳原子的烃,B是饱和链烃的一元含氮衍生物。则A的分子式为________,B的分子式为________。符合B的分子式的同分异构体有________种。
(8分)有机物A可视为是烃B分子中的所有氢原子被烃C分子中最简单的烃基取代而得到的。且已知:
①A遇Br2的CCl4溶液不褪色,其一氯代物只有一种。
②一定量的B完全燃烧,产物中n(CO2) ∶n(H2O)=2 ∶1,且26<Mr(B)<78。
③烃C为饱和链烃,通常情况下呈气态,其同分异构体不超过2种,而二溴代物有3种。
试回答下列问题:
(1)烃B的最简式为________,分子式为________。
(2)烃C的3种二溴代物有结构简式为:________________,________________,________________。
(3)A的分子式为________。
(8分)相对分子质量为174的有机物M中只含有C、H、O三种元素,其分子结构如图所示。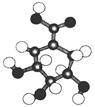
请回答下列问题:
(1)M的结构简式是________。
(2)下列关于M的说法,正确的是
________________________________________________________________________。
A.遇FeCl3溶液呈紫色 B.遇紫色石蕊溶液变红
C.遇溴水发生取代反应 D.能缩聚为高分子化合物
(3)M在一定条件下发生消去反应,生成 ,该反应的化学方程式是
,该反应的化学方程式是
________________________________________________________________________
________________________________________________________________________。
(4)M与有机物A在一定条件下可生成一种相对分子质量为202的酯类物质。A可能的结构简式是________。
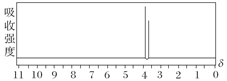
(5)研究发现,有一种物质B的分子组成和M完全一样,但分子中无环状结构;B在一定条件下水解能够产生甲醇;B的核磁共振氢谱如图(两个峰面积比为2 ∶3),物质B的结构简式是:
________________________________________________________________________。
(8分)(1)组成符合CnH2n-2的某种烃,分子结构中没有支链或侧链。它完全燃烧时所消耗O2的体积是同状况下该烃蒸气体积的8.5倍,由此分析回答:①若该烃为链状二烯烃,并且与等物质的量的Br2加成后只能得到单一产物,请写出化学反应方程式__________________(有机物用结构简式表示)。
②若该烃只能与等物质的量的Br2发生加成反应,则其结构简式为________(任填一种)。
(2)有机物A由于其特殊的结构,一直受到理论化学家的注意,由于缺乏有效的合成途径,一度延缓对其反应的研究,直到1993年出现了可以大量制备的方法,才得以被重视。烯烃A是非极性分子,化学式是C6H8,核磁共振表明分子中只有一个吸收峰。
①A的结构简式为________;A分子中在同一平面上的碳原子数为________。②A的二氯代物的同分异构体有________种。
(8分)(1)按系统命名法填写下列有机物的名称:
CH3CHC2H5CHCH3(CH2)3CH3的名称是________。
(2)2,6二甲基4乙基辛烷的结构简式是________,1 mol该烃完全燃烧需要消耗氧气________mol。
(3)在烃的分子结构中,若每减少2个氢原子,则相当于碳碳间增加1对共用电子。试完成下列问题:
①分子式为CnH2n+2的烃分子中碳碳间共用电子对数为________。
②有n对共用电子对的单烯烃的分子式为________。
(4)如图是由4个碳原子结合成的6种有机物(氢原子没有画出)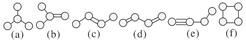
①写出有机物(a)的系统命名法的名称________。
②有机物(a)有一种同分异构体,试写出其结构简式
________________________________________________________________________。
③上述有机物中与(c)互为同分异构体的是________(填代号)。
④与(e)互为同系物的最简单有机物的结构简式为:
________________________________________________________________________。
⑤上述有机物中不能与溴水反应使其褪色的有________(填代号)。
⑥(a)(b)(c)(d)(e)五种物质中,4个碳原子一定处于同一平面的有________(填代号)。