实验室里现有过氧化氢溶液、二氧化锰、稀硫酸、石灰石、稀盐酸,以及下列仪器:

(1)仪器⑦名称 。
(2)用上述仪器和药品可以制取二氧化碳,需选择的仪器序号是 ,若要检验二氧化碳气体,需补充一种溶液,这种溶液中溶质的俗称是 ,二氧化碳验满的方法 _______ 。
(3)再利用上述仪器和药品,还可以制取 ,收集方法是 ,反应的化学方程式是 ,基本反应类型 。
尿素[CO(NH 2) 2]在工农业生产中应用广泛。
(1)尿素溶液能除去工业废气Cl 2.化学方程式为:CO(NH 2) 2+H 2O+3Cl 2=N 2+CO 2+6X,则X的化学式是 。
(2)尿素是目前使用量较大的一种 (选填"氮"、"磷"或"钾")肥,适用于各种植物,某水田施加7.2千克尿素,其中含氮元素多少千克?
蜡烛(主要含C、H、O元素)在密闭容器中熄灭的原因是什么?燃烧的产物是什么?小敏认为蜡烛熄灭的原因是燃烧消耗完了容器内的氧气,并对燃烧产物提出猜想:
①燃烧的产物可能有CO 2。
②燃烧的产物可能有H 2O。
除了上述猜想,你的猜想,燃烧的产物可能有 。
实验一:在密闭容器中点燃蜡烛至熄灭,抽取10毫升密闭容器中的气体,注入到试管中的饱和澄清石灰水中,发现石灰水始终没有变浑浊,从实验的科学性考虑,下一步是 (选填字母)。
A.直接得到燃烧产物中没有CO 2的结论
B.再多抽取一些气体注入到试管中的石灰水中
C.增加饱和澄清石灰水的质量
实验二:在老师的指导下,利用多功能传感器进行有关量的测量,装置如图所示,实验结束后,铝板表面有黑色
固体颗粒,同时传感器采得实验前后的有关数据如表所示:
|
相对湿度 |
氧气含量 |
二氧化碳含量 |
一氧化碳含量 |
|
|
蜡烛点燃前 |
48.4% |
18.7% |
0.058% |
0 |
|
蜡烛熄灭后 |
71.6% |
15.6% |
3.643% |
0.0182% |
由实验及结果分析,密闭容器内蜡烛熄灭的原因是 ;蜡烛燃烧生成的产物是 。

小柯探究pH对唾液淀粉酶活性的影响,其实验过程及结果如下:
|
组别 |
A |
B |
C |
|
试管中依次 加入物质 |
1ml唾液 |
1ml唾液 |
1ml唾液 |
|
1ml盐酸溶液 |
1ml蒸馏水 |
1ml氢氧化钠溶液 |
|
|
2ml淀粉溶液 |
2ml淀粉溶液 |
2ml淀粉溶液 |
|
|
水浴10分钟 |
37℃ |
37℃ |
37℃ |
|
各滴入2滴 碘液后的现象 |
变蓝 |
不变蓝 |
不变蓝 |
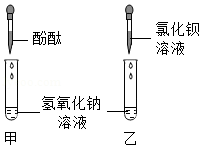
(1)B组实验不变蓝的原因是 .小柯观察到C组也不变蓝,认为氢氧化钠对酶的活性没有影响.老师提示他:"氢氧化钠会影响酶的活性."那么,是什么原因导致C组没变蓝?小柯进一步分析并做出猜想.
猜想一:氢氧化钠变质.
猜想二:氢氧化钠与碘发生了化学反应.
…
(2)小柯按图甲实验,看到溶液变红,认为氢氧化钠没有变质.小常认为他的结论是错误的,理由是 .
在小常的建议下,小柯按乙实验,溶液中没有沉淀产生,从而排除了猜想一.
(3)在原来C组实验基础上,只要继续 (写出操作和现象),就可以证明猜想二正确.
整理实验器材时,小柯将还在反应的锌和稀硫酸的残留物,倒入有少量硫酸铜溶液的废液缸中,观察到锌粒表面产生气泡的速度大大加快。对此,他十分好奇:与硫酸铜溶液混合怎么会加快锌和稀硫酸的反应速度?
查阅资料:①相互接触的两种活动性不同的金属,同时放入酸中,活动性较强的金属与酸反应产生氢气的速度会大大加快。 ②硫酸铜对锌和稀硫酸反应没有催化作用。
小柯根据下表进行实验,观察并记录现象。
|
组别 |
第一组 |
第二组 |
||
|
A |
B |
C |
D |
|
|
金属 |
锌片 |
绑有铜片的锌片 |
铁片 |
绑有铜片的铁片 |
|
30%硫酸溶液(ml) |
20 |
? |
20 |
20 |
|
产生气泡快慢 |
快 |
明显加快 |
慢 |
明显加快 |
(1)第一组实验中"?"处的数据应为 。
(2)为了定量比较产生气体的快慢,可以测量"收集相同体积的氢气所需的时间"或测量 ,然后进行比较。
(3)请推测与废液缸中少量硫酸铜溶液混合后,锌料与稀硫酸反应速度加快的原因 。
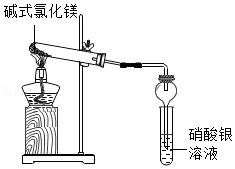
碱式氯化镁[Mg(OH)Cl]受热能分解,它分解后产物是什么?小科进行了探究。
【猜想】Mg(OH)Cl分解后产物可能有:Mg、MgCl 2、MgO、HCl气体、H 2O、Cl 2。
【实验一】取少量的Mg(OH)Cl放入大试管中,按如图所示装置进行实验,加热过程中观察到足量硝酸银溶液中有白色沉淀产生,一段时间后,沉淀不再产生,大试管口也没有液滴形成,管内有固体剩余,无其他现象。由此推知Mg(OH)Cl分解后产物中有 气体,无其他气体。
【实验二】取少量实验一的剩余固体于试管中,加入足量稀盐酸,没有气泡产生,由此推知Mg(OH)Cl分解后产物中没有 。
【实验三】再取少量实验一的剩余固体,加入足量稀硝酸,固体全部溶解,再滴入AgNO 3溶液,无沉淀产生,由此推知Mg(OH)Cl分解后产物中没有 。
【结论】Mg(OH)Cl受热分解的化学反应方程式为 。