热水瓶用久后,瓶胆内壁常附着一层水垢,其成分是碳酸钙、氢氧化镁及少量水,实验室现有一瓶水垢样品,为测定其中各成份的质量分数,某化学兴趣小组的同学利用如图所示装置进行实验(该装置气密性良好,A、C、D中所装药品足量)。
已知:碱石灰是氧化钙和氢氧化钠的混合物;加热条件下,氢氧化镁易分解,反应的化学方程式为:Mg(OH)2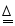 MgO+H2O↑。
MgO+H2O↑。
部分实验步骤如下:
Ⅰ.将质量为m的样品装入装置B的玻璃管中,按图连接好装置,关闭弹簧夹,给样品加热;
Ⅱ.待样品完全反应,先打开弹簧夹通入空气,再熄灭酒精喷灯,直到玻璃管冷却;
Ⅲ.实验完毕,测得装置C、D中的液体质量分别增加了m1、m2;
Ⅳ.根据实验所测数据计算该样品中碳酸钙、氢氧化镁和和水的质量分数。
请回答下列问题:
(1)装置C中所装药品为 。
(2)装置D中发生反应的化学方程式为 。
(3)该水垢样品中碳酸钙的质量分数表达式为 。
(4)实验反思:实验步骤不变,若没有装置A,会导致氢氧化镁的测定结果 (填“偏大”、“偏小”或“无法判断”)。
回收利用是保护金属资源的一条有效途径,某工业废料含氧化铜和氧化铁,经过处理后可得到铜和硫酸亚铁溶液.主要流程如图:

已知:CuO+H 2SO 4═CuSO 4+H 2O Fe+Fe 2(SO 4) 3═3FeSO 4
(1)流程Ⅰ中氧化铁发生反应的化学方程式是 .
(2)流程Ⅲ充分反应后,还应有的实验操作是 .
(3)A﹣E中,含有铁、铜两种元素的是 (填字母).
充有的蒸汽的高压钠灯发出的黄光射程远,透雾能力强,常用于道路和广场的照明.钠的化学性质活泼,常温下可以与氧气、水反应,在实验室里,金属钠保存在煤油中,用镊子从煤油中取出金属钠,放在滤纸上,用小刀切下一小块,投入盛有水(滴有酚酞溶液)的烧杯中,发现钠块浮在水面上,很快熔化成银白色小球,四处游动,发出嘶嘶的响声,偶有火星出现,溶液变成红色.依据提供的信息,回答下列问题.
(1)"钠保存在煤油中"说明钠具有的化学性质是 .
(2)"钠块浮在水面上"说明钠具有的物理性质是 .
(3)"溶液变成红色"说明钠与水反应的生成物中含有 性的物质.
(4)根据所学知识解释钠"熔化成银白色小球"的原因是 .

(1)喝口水缓解考试压力,我带的开水是 (填"纯净物"或"混合物"),它已经通过 降低了水的硬度.
(2)化学考试结束回到家,啊,餐厅里飘来了饭的香味,这是因为 (从微观角度解释)…先吃一碗带汤排骨,再吃碗干饭拌青菜.这些食物中除了水、无机盐和油脂外,主要含有的营养素是 、 、 .
(3)家里煮菜用液化石油气,除了石油外,化石燃料还有 、 .液化石油气的主要成分C 4H 8完全燃烧的产物是二氧化碳和水,则其完全燃烧的化学方程式是 .
以下是金属锡纯度的一种测定方法:
步骤i 将样品全部溶于盐酸生成SnCl 2溶液;
步骤ii 往所得SnCl 2溶液加入过量的FeCl 3溶液,发生反应:
SnCl 2+2FeCl 3═SnCl 4+2FeCl 2
步骤iii 用K 2Cr 2O 7溶液测定步骤ii反应生成FeCl 2的质量.
现有金属锡样品1.20g,经上述方法测得生成的FeCl 2质量为2.54g(假设杂质不参加反应),计算并回答:
(1)样品溶于盐酸生成的SnCl 2质量;
(2)样品中锡的质量分数(精确到0.01%)
某治疗胃酸过多的药片主要成分为碳酸氢钠.为测定药片中碳酸氢钠的含量,将药片研碎,取4.0g样品加热到质量不再减少时,收集到的气体经干燥后质量为0.88g.(碳酸氢钠受热分解的化学方程式:2NaHCO 3 Na 2CO 3+H 2O+CO 2↑,样品中其他成分受热不分解)
(1)碳酸钠中钠、碳、氧三种元素的质量比是 (最简整数比);
(2)计算该样品中碳酸氢钠的质量分数.