如图所示,某活动小组为验证氢氧化钠和氢氧化钙的性质,设计并进行以下实验(装置气密性良好):分别打开分液漏斗活塞,将等体积的氢氧化钠饱和溶液和氢氧化钙饱和溶液全部加入锥形瓶中,关闭活塞,打开弹簧夹K1、K2,观察实验现象。
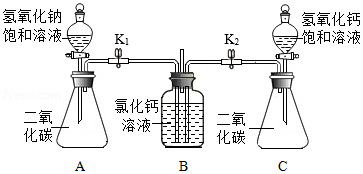
(1)B中的短导管可使集气瓶内外的气压保持一致,这样设计的目的是什么?
(2)以上实验证明氢氧化钠、氢氧化钙能与二氧化碳反应,根据哪些现象能判断出氢氧化钠与二氧化碳确实发生了反应?该实验还能验证氢氧化钠和氢氧化钙的什么性质?
(3)实验后,从A中锥形瓶内取出适量溶液,倒入试管中,设计实验证明该溶液中含有氢氧化钠,写出实验操作及现象。
如图是初中化学中常见物质间的转化关系,其中A是氧化物,B是碱、C是单质,无色溶液中只含一种溶质,各物质间恰好完全反应(部分产物已略去)。

请你根据以上信息回答下列有关问题:
(1)无色溶液中初中的离子是(填离子符号) 。
(2)有关反应的化学方程式:黄色溶液与硝酸钡溶液的反应 。蓝色溶液与C的反应 。
(3)X的化学式为 。
A、B、C、D、E、F、G、H、I、J、X、Y都是初中化学中的常见物质,已知A是小苏打的主要成分,F是大理石的主要成分,J、X是单质,通常情况下C为液体。它们之间有如下图的反应关系。

请你回答下列有关问题:
(1)有关物质的化学式:A为 ,E为 。
(2)有关反应的化学方程式:
I分解的反应 。
F与Y的反应 。
辉铜矿的主要成分为硫化亚铜(Cu2S),工业上用辉铜矿冶铜的一种工艺流程图如下:

请你回答下列有关问题:
(1)硫化亚铜中铜元素的化合价为 。
(2)焙烧炉Ⅱ中发生反应的化学方程式为 。
(3)二氧化硫与二氧化碳具有相似的化学性质,则x溶液中盐的化学式是 。
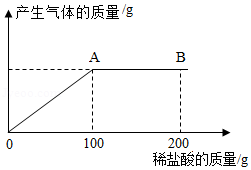
我国化学家侯德榜创立了侯氏制碱法,为世界制碱工业作出了突出贡献。在实际生产的产品碳酸钠中会混有少量的氯化钠,现有该样品混合物20.4g,将其放入一洁净的烧杯中,向其中逐滴滴入7.3%的稀盐酸,放出气体质量与滴加稀盐酸质量的关系如图所示。请回答下列问题:
(1)当滴加稀盐酸至图中B点时,烧杯中溶液的pH 7(填"<"">"或"=");
(2)该样品混合物中碳酸钠的质量 g;
(3)当滴加稀盐酸至图中A点时,烧杯中所得溶液为不饱和溶液,请计算此时溶液中的溶质质量分数。(写出计算过程,计算结果保留至0.1%)。
甲、乙两组同学为探究氢氧化钙的化学性质,分别做了如下相同的四个实验: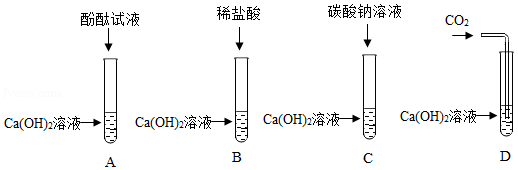
请回答下列问题:
(1)试管D中的现象是 。
(2)以上实验中,能发生反应但无明显现象的化学方程式 。
[继续探究]
实验结束后,甲、乙两组同学分别将本组A、B、C、D四支试管中的物质各倒入一个洁净的大烧杯中,充分反应后静置,发现:
①甲组烧杯底部有白色沉淀,上层清液为无色。则上层清液中一定含有的溶质是 (指示剂除外),可能含有的溶质是 。
②乙组烧杯底部有白色沉淀,上层清液为红色,则上层清液中一定没有的离子是 。
[拓展延伸]
甲、乙两组同学共同讨论后一致认为两个烧杯底部的白色沉淀为同一物质,请写出本实验过程中产生该白色沉淀的化学方程式 (写一个即可)。