中和反应在工农业生产和生活中有广泛的应用。某化学实验小组的同学对酸碱中和反应进行了如下研究。
【实验过程1】对于没有明显实验现象的中和反应,如稀盐酸与稀氢氧化钠溶液的反 应,要证明它们之间确实发生了化学反应,可通过如图所示实验步骤进行操作。
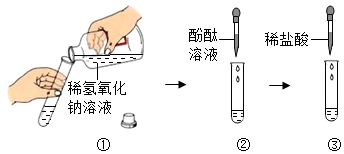
请根据上图所示实验步骤填写实验报告:
实验步骤 |
实验现象 |
实验结论 |
①向试管中加入1~2ml稀氢氧化钠溶液 |
|
NaOH与HCl 发生了中和反应 |
② |
|
|
③ |
|
【实验过程2】对于某些有明显现象产生的中和反应,如稀盐酸与氢氧化铝的反应,观察到有 的现象,就可以说明中和反应已经发生。该反应的化学方程式为 。[提 示:氢氧化铝是不溶于水的白色固体,其化学式为Al(OH)3]
【实验反思】
(1)有同学提出也可以使用石蕊溶液代替酚酞溶液进行【实验过程1】的实验。你认为 (填“酚酞溶液”或“石蕊溶液”)更适合用于验证稀盐酸与稀氢氧化钠溶液发生中和反应,你的理由是 。
(2)对于没有明显现象出现的酸碱中和反应,我们可以借助 的变化,来判断是否反应或反应进行的程度。
根据如图回答有关问题:
(1)仪器D的名称是 。
(2)实验室制取并收集二氧化碳需在图中选用A、C、G与 (填序号)组合;检验二氧化碳是否集满的方法是 。实验室用该装置制氧气的化学方程式为 。
(3)将二氧化碳通入氢氧化钠溶液中无明显现象,为探究二氧化碳是否与氢氧化钠发生了反应,思成同学利用如图中图甲装置测定二氧化碳浓度变化,采集数据绘制成曲线(如图乙)。据图乙分析,能说明二氧化碳与氢氧化钠发生反应的时间段是 到 。ab段二氧化碳浓度不变的原因是 。

天然气(主要成分为CH4)作为清洁能源,正逐步走进城乡居民生活。
(1)“西气东输”工程利于国家能源和产业结构调整,极大改善了沿线居民生活质量。
①为防止传输天然气的钢管被腐蚀,可采取的措施有 (写出一种)。
②CH4完全燃烧的化学方程式是 ,该过程 (填“释放”或“吸收”)能量。
③天然气的使用可有效减少酸雨形成。下列现象与酸雨有关的是 。
A.石刻文物被腐蚀
B.全球海平面上升
(2)工业上以CH4为原料生产H2,制取原理如图所示:
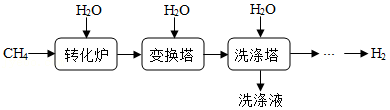
已知变换塔、洗涤塔发生的主要反应依次是:CO+H2O CO2+H2,CO2+H2O═H2CO3。
CO2+H2,CO2+H2O═H2CO3。
①“转化炉”中有H2产生,参加反应的CH4与H2O的质量比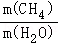 = 。
= 。
②“洗涤塔”中气体从塔底通入,水从塔顶喷淋。这样操作的优点是 。
③若有32g CH4参与反应(假设各步反应都完全转化),理论上可制得 g H2。
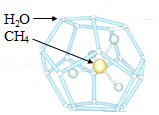
(3)我国是世界上首个成功试采海域可燃冰的国家。可燃冰是CH4被H2O分子形成的笼包裹,在海底低温和高压作用下形成的结晶物质。
①可燃冰样品常存放于液氮储存罐中,其原因是 。
②可燃冰有多种结构,某H型可燃冰的化学式为CH4•9H2O,分析其结构发现:平均34个H2O分子构成6个笼,每个笼只容纳一个CH4或H2O分子。这6个笼内容纳的CH4与H2O分子个数比是 (填最小整数比)。
铜及其化合物在生产生活中有重要应用。某同学对铜及某些含铜物质进行探究。
[温故如新](1)在①CuO②Cu(OH)2③CuCl2④Cu2(OH)2CO3[也可表示为CuCO3•Cu(OH)2]这4种物质中,属于碱的有 (填序号));除①CuO外,其余3种物质在常温下易溶于水有 (填序号)。
(2)考古出土的春秋末期制造的青铜剑,历经2500余年,其表面且有一层薄锈,但仍寒光逼人,剑刃锋利。由此可知,青铜具有的特性有 (任写一条)。铜器表面的薄锈是铜与空气中的氧气、水、 等物质发生反应所形成。
[提出问题]除H2、CO能还原CuO外,是否还有其他气体能够还原CuO得到金属铜?怎样从含CuCl2、FeCl3的某工业废液中回收金属铜和FeCl2溶液?
[查阅资料]a.通常状况下,氨气极易溶于水形成溶液;加热时,氨气能与CuO反应生成氮气和金属铜等,可用如图所示装置验证。b.在溶液中能发生反应2FeCl3+Fe═3FeCl2。
[进行实验1](3)按图示连接装置,检查气密性后,加(通)入相关药品,后续操作均按规范要求进行,完成实验。
①将CuO粉末装入玻璃管A中的具体操作方法是 。
②实验时,在试管B中能够观察到的现象是有液体出现,该液体是 (填“纯净物”或“混合物”)。
③从环保角度看该装置的不足之处是 。
[进行实验2](4)取适量含CuCl2、FeCl3的某工业废液样品,向其中加入过量铁粉并充分反应后,过滤,将滤渣和足量 (填“稀盐酸”或“稀硫酸”)充分反应,再
(填操作名称)、洗涤、干燥即可回收得到金属铜;所得滤液中含有需要回收的FeCl2。
[拓展延伸](5)已知:加热时,葡萄糖溶液与氢氧化铜悬浊液能发生反应。实验室可用CuSO4溶液等物质检验葡萄糖的存在,具体实验过程为:在试管中加入2mL 10%NaOH溶液,滴加5% CuSO4溶液5滴(每滴溶液按0.04mL计算。两种溶液的密度均按1g/mL计算),混合均匀,充分反应,得混合物A。再向上述试管中加入几滴10%葡萄糖溶液,并在酒精灯上加热至沸腾,片刻后生成红色沉淀B,检验完成。则混合物A显 (填“中性”或“碱性”);红色沉淀B是 [填“CuO”或“Cu2O”“或“Cu(OH)2”]。

请根据下列实验装置图回答问题。

(1)写出标号仪器的名称:①是 ,②是 。能用装置E收集的气体应具有的性质是 。
(2)实验室用过氧化氢溶液和MnO2混合制O2时MnO2的作用是 。收集较纯净的氧气,装置可用 (填字母)。用锌与稀硫酸反应制取氢气的化学方程式为 。
(3)实验室可用铜片与浓硝酸在常温下反应制取少量二氧化氮(NO2)。通常状况下,二氧化氮是红棕色气体,溶于水时与水反应生成硝酸和一氧化氨(NO)。
①制取NO2的发生装置可用 (填字母)。
②收集NO2不用装置F的原因是 (用化学方程式表示)。
如图为实验室常用仪器和实验装置的示意图,根据题意回答问题。

(1)写出标号①的仪器名称 。
(2)实验室用装置A制取CO2的原料为 (填物质名称)。若将装置A改为装置B,其优点是 。若用装置C收集CO2,气体应从
(填“a”或“b”)端通入。
(3)FeS固体和稀硫酸之间可发生复分解反应,该反应常用于实验室制取H2S。H2S气体有毒,能溶于水,其水溶液为氢硫酸。
①写出制取H2S气体的化学方程式 。
②某同学用D、E、F装置组合收集H2S。E装置的作用是防倒吸,则虚线框内最合适的装置是 (填“甲”或“乙”,请从图2中选择);F装置的作用是 。