某兴趣小组对石灰石样品进行如下实验分析:取12g样品放入烧杯中,将100g稀盐酸分4次加入到烧杯中,充分反应后(杂质不溶于水,也不与酸反应),测得剩余固体的质量记录如下。请计算:
次数 |
1 |
2 |
3 |
4 |
加入稀盐酸的质量/g |
25 |
25 |
25 |
25 |
剩余固体的质量/g |
8 |
4 |
2 |
2 |
求:
(1)样品中碳酸钙的质量为 g:
(2)第4次加入稀盐酸后所得溶液中CaCl2的质量分数。(写出计算过程,最终结果保留0.1%)。
小兰进行水的电解实验时,在水中加入少许硫酸钠以增强导电性。她将2.7g硫酸钠固体加入52.7g水中充分溶解,倒入电解器中通电,当正极产生4.8g氧气时结束实验。忽略气体在水中的溶解,请计算(写出计算过程):
(1)负极产生氢气的质量;
(2)实验结束时所得溶液的溶质质量分数。
诺贝尔生理学和医学奖的一次重大失误是1948年授予了瑞士化学家米勒,他发明的剧毒有机氯杀虫剂DDT (化学式C 14H 9Cl 5)带来了许多环境问题,后来被禁用。试计算:
(1)一个DDT分子是由 个原子构成;
(2)DDT中碳元素和氢元素的质量比为 (填最简整数比)。
氧化钴(CoO)溶于盐酸可得到粉红色的氯化钴(CoCl 2)溶液。CoCl 2含结晶水数目不同而呈现不同颜色。利用蓝色的无水CoCl 2吸水变色这一性质可制成变色水泥和显隐墨水。如图是粉红色的六水氯化钴晶体(CoCl 2•6H 2O)受热分解时,剩余固体质量随温度变化的曲线。
已知:①CoCl 2•6H 2O的相对分子质量为CoCl 2和6个结晶水的相对分子质量之和。
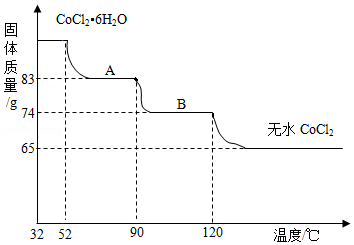
②CoCl 2•6H 2O受热分解完全脱水的化学方程式为:CoCl 2•6H 2O 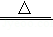 CoCl 2+6H 2O。
CoCl 2+6H 2O。
请回答:
(1)CoCl 2的钴元素的化合价为 价。
(2)求物质A(CoCl 2•xH 2O)中的x值。
工业上常用熟石灰(主要成份:Ca(OH) 2)和纯碱(主要成份:Na 2CO 3)混合加工制取烧碱(化学式:NaOH)。请问:工业上制取40吨烧碱,需要消耗含Na 2CO 3质量分数为90%的纯碱多少吨?(计算结果保留一位小数)
为探究铁的化学性质,某学习小组做了如图甲所示实验。他们观察到试管a中铁粉全部溶解,产生大量气泡,溶液呈① 色,反应的化学方程式为② ;试管b中有③ 色固体生成,该反应的化学方程式为④ 。为进一步确定试管a所得溶液中的溶质成分和试管b所得固体的组成,他们进行了以下实验探究。

【提出猜想】(1)试管a中的溶质成分:猜想一:FeSO 4;猜想二:⑤ 。
(2)试管b中固体的组成:猜想三:Cu; 猜想四:Fe和Cu。
【实验探究】甲图所示实验结束后,将试管a、试管b内的物质全部倒入同一烧杯中(如乙图所示),他们惊奇地发现烧杯内溶液中产生大量气泡。
【总结交流】经过讨论,大家一致认为上述猜想中正确的是⑥ 。
【拓展探究】某混合溶液由硫酸铜和硫酸溶液组成。上述小组同学取192.4g该混合溶液于烧杯中,然后往其中加入33.6g铁粉,充分混合后,恰好完全反应。实验测得反应过程中产生气体的质量为0.4g。计算:
(3)原混合溶液中H 2SO 4的质量。(计算结果保留一位小数)
(4)原混合溶液中CuSO 4和H 2SO 4的质量比。
(5)完全反应后所得溶液中溶质的质量分数。(计算结果保留一位小数)