硝酸钾和氯化钾的溶解度曲线如图所示:
(1)t1℃时,硝酸钾的溶解度为 。
(2)t1℃时,将50g硝酸钾加入到50g水中,充分溶解后,所得溶液中溶质的质量分数为 。
(3)t2℃时,氯化钾的饱和溶液中含有少量硝酸钾,提纯氯化钾的方法是 。
(4)将t3℃时硝酸钾和氯化钾的饱和溶液各100g分别蒸发10g水,然后降温至t2℃过滤,得到溶液a和溶液b。对于溶液a和溶液b,下列说法正确的是
A.都是饱和溶液
B.溶液质量a<b
C.溶质质量a=b
D.溶剂质量a<b
E.溶质的质量分数a=b

化学与生活息息相关,请从水、碳酸氢钠、植物油、生石灰几种物质中,选择适当的物质完成下列各题。
①最常用环保的溶剂是 ,②可用于做干粉灭火器的是 。
③用作某些食品干燥剂的是 ,④与水混合并振荡,能形成乳浊液的是 。
将V1mL3.65% HCl溶液逐滴滴入盛有V2mL未知浓度的
NaOH溶液的烧杯中(图1),测量并记录溶液的pH变化(图2)和
温度变化(图3)。(实验中始终保持 V1+V2=50.0mL且各种溶液密度
均为1.0g/mL)。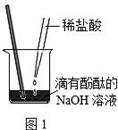
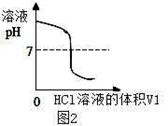
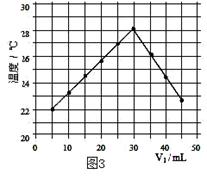
(1)图2中V1="0" mL时,图1中烧杯内溶液的颜色显色;
(2)实验中发生反应的化学方程式为;
(3)图2中的pH=7时,此时滴入的HCl溶液的体积V1=mL;
(4)通过该实验给出的判断,其中正确的是;
| A.进行该实验时环境温度为22℃ |
| B.该实验表明化学能可转化为热能 |
| C.该实验表明有水生成的反应都是放热反应 |
| D.溶液由碱性转变为中性,再转变为酸性且酸性不断减弱 |
(5)实验中所用NaOH溶液的溶质质量分数为。
硝酸钾是初中化学常见的一种物质。请按要求填空:
(1)质量分数为4.04%的硝酸钾(KNO3)溶液可作为无土栽培的营养液。该营养液(填“属于”或“不属于”)复合肥;
(2)在硝酸钾溶液中,共有三种微粒,它们是K+、NO3-和(用符号表示);
(3)黑火药爆炸的反应原理是:2KNO3+S+3C K2S+3CO2↑+N2↑,此反应的反应物和生成物中,没有涉及到下列物质类别中的(填序号)
K2S+3CO2↑+N2↑,此反应的反应物和生成物中,没有涉及到下列物质类别中的(填序号)
| A.单质 | B.氧化物 | C.酸 | D.碱 E.盐 |
(4)如右图,硝酸钾的溶解度随温度的升高而,50℃时,硝酸钾和氯化钠饱和溶液降温至20℃后,硝酸钾的溶质质量分数氯化钠的溶质质量分数(填“﹥”、“﹦”或“﹤”),欲将接近饱和的 KNO3溶液变成饱和溶液,可采取的方法有(列举一种)。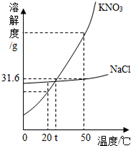
金属材料在工业上有广泛的用途。
(1)铝合金材质与纯铝比较,主要优点是;
(2)钢铁的锈蚀主要是铁与空气中的共同作用的结果,工业生产中常用稀盐酸除去铁制品表面的铁锈,该反应的化学方程式为;
(3)为了避免钢铁腐蚀,通常在钢铁外壳上镶嵌比铁活动性强的金属。小明为探究锌、铁、铜三种金属的活动性顺序,设计了如图的两个实验: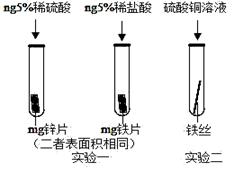
①实验一,小明以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不够合理,理由是;②实验二,若出现现象,可证明铁的活动性强于铜,该反应的化学方程式为。
化学是以实验为基础的科学。根据所学知识,完成下列问题。
(1)实验A中标号为①的仪器名称是,实验A制取氧气发生的化学方程式为;
(2)实验B的操作是违规的,正确方法是;
(3)实验C中烧杯③的作用是;
(4)实验D中,气球的变化情况是先变大后变小,写出导致气球变小的化学方程式。