巴中某超市卖的纯碱(Na2CO3)产品往往含有少量的氯化钠(NaCl),化学兴趣小组的同学通过实验来测定该纯碱样品中纯碱的质量分数.他们取12g纯碱样品放入烧杯中,逐滴加入稀盐酸至不再产生气泡为止,共消耗盐酸100g,烧杯中没有残留不溶物,称得反应后溶液的质量为107.6g.计算:
(1)生成二氧化碳 g.
(2)样品中纯碱的质量分数是多少?(要求写出计算过程,结果精确到0.1%)
某无色溶液X是碳酸钠、碳酸氢钠、氢氧化钠溶液中的一种或两种溶液的混合溶液。某兴趣小组的同学为探究无色溶液X的成分,开展了如下的探究活动,请你一同参与完成:
[查阅资料]获得如下信息:
1.氯化钙溶液呈中性,与碳酸氢钠溶液混合不发生反应。
2.NaHCO3溶液呈碱性,与澄清石灰水反应生成白色沉淀。
[猜想与假设]针对无色溶液X中的溶质成分:
猜想一:含有Na2CO3
猜想二:含有 NaHCO3
猜想三:含有 ;
猜想四:是其中两种成分的混合溶液
[实验方案设计]
|
序号 |
实验步骤 |
预设实验现象 |
预设实验结论 |
|
① |
取样于烧杯中,滴入过量的氯化钙溶液,过滤 |
产生白色沉淀 |
猜想一 |
|
② |
取①的滤液于试管中,滴入适量的氢氧化钙溶液 |
|
猜想二不正确 |
|
③ |
取①的滤液于试管中,滴入 溶液 |
溶液变红色 |
猜想三正确 |
[综合结论]通过以上实验,得出无色溶液X是 。
[实验反思与拓展]
类比资料信息,NaHCO3与NaOH反应生成质量比为53:9的两种化合物,请写出反应的化学方程式 。
如图是实验室常用的部分实验装置,请按要求回答问题。
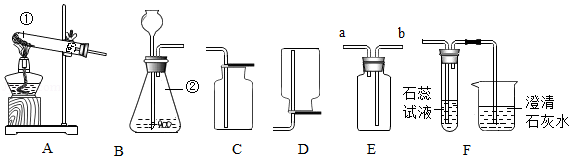
(1)写出标有编号的仪器名称:① ,② 。
(2)用加热高锰酸钾的方法制取氧气,所选择的发生和收集装置是 (填字母序号),写出反应的化学方程式 ;检验氧气收集满的方法是 。
(3)将装置B、E、F相连接用于制取二氧化碳气体并验证其化学性质,若E装置中装有饱和碳酸氢钠溶液,则F装置中可观察到的现象:试管中石蕊溶液 ,烧杯中澄清石灰水 。
(4)下列实验的相关说法不正确的是 (填数字序号)。
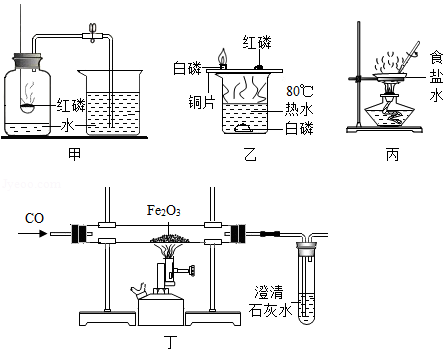
①甲实验中,红磷要过量
②乙实验中,水中的白磷没有燃烧,是因为白磷没有跟氧气充分接触
③丙实验中,搅拌的目的是防止局部温度过高,造成液滴飞溅
④丁实验开始时,先加热,后通入一氧化碳
医疗上常用硫酸钡作透视肠胃的内服剂,俗称“钡餐”。若误将碳酸钡代替硫酸钡作“钡餐”,就会致人中毒。为除去某硫酸钡中混有的碳酸钡,并得到硝酸钡溶液。现取25g该硫酸钡和碳酸钡的混合物于烧杯中,逐滴加入稀硝酸至恰好完全反应,共用去稀硝酸245.7 g,反应后称得烧杯中物质总质量为266.3 g。
(温馨提示:化学反应方程式为BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑) 请计算:
(1)生成二氧化碳 g;
(2)所得硝酸钡溶液中溶质的质量分数。
甲、乙两个化工厂的废液中共含有硫酸铜、硫酸、碳酸钠和氢氧化钠四种溶质,每个厂各含其中两种。某校社会实践小组的同学对两个厂的废液成分进行探究。
(1)取甲厂的废液观察,废液呈蓝色,结合溶液中物质共存的原理可推知,甲厂废液中的溶质是 ,将所取废液部分倒入试管中并加入足量锌片,观察到的实验现象是 。
(2)同学们设计以下实验对乙厂废液中的成分进行了验证。
|
实验步骤 |
实验现象 |
实验结论 |
|
实验一:取少量乙厂废液于试管中,滴入足量Ba(NO3)2溶液 |
产生白色沉淀 |
乙厂废液中含有 |
|
实验二:取实验一试管中的上层清液,滴入 |
|
①请写出实验一中发生反应的化学方程式 。
②下列物质可以代替实验一中Ba(NO3)2溶液的是 。
A.稀盐酸 B.氢氧化钡溶液
C.氯化钡溶液 D.氢氧化钙溶液
如图1是实验室制取气体的常用装置,请回答下列问题。
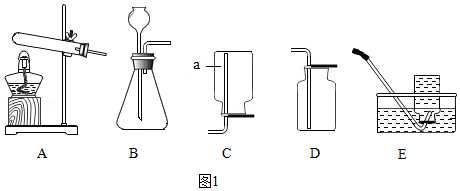
(1)写出仪器a的名称 。
(2)实验室用大理石和稀盐酸反应制取二氧化碳,发生和收集装置和组合是 。
(3)实验室用高锰酸钾制取氧气,反应的化学方程式为 ,若用E装置收集氧气,收集结束要先移出导管再熄灭酒精灯,原因是 。
(4)碳酸氢钠加热生成碳酸钠、水、和二氧化碳。为验证碳酸氢钠加热有二氧化碳气体生成,小明用如图装置进行实验。他认为只要观察到小气球膨胀,就能说明生成了二氧化碳。同学们讨论后认为小明依据不充分,原因是 。小红认为在X处预先加入少量澄清石灰水,观察到 ,就可证明有二氧化碳生成,也可将澄清石灰水换作 同样能证明。
