某同学在实验室中用盐酸与石灰石反应,将制得的气体通入澄清石灰水中,发现石灰水始终不变浑浊,于是该同学对不变浑浊的原因进行了如下实验探究。
【查阅资料】CO2既不与AgNO3溶液反应,也不与饱和NaHCO3溶液反应。
【提出猜想】①澄清石灰水已经变质。
②制得的气体中除CO2外还含有其他成分。
【实验探究】
活动一:为了验证猜想①,该同学做了一个对照实验:把稀硫酸滴入盛有碳酸钾溶液的试管中,并将产生的气体通入澄清石灰水,石灰水变浑浊。则稀硫酸与碳酸钾溶液反应的化学方程式为 。由该实验得出的结论是:猜想① (填“成立”或“不成立”)。
活动二:将盐酸与石灰石反应制得的气体通入硝酸银溶液中,观察到有 产生,说明制得的气体中含有HCl气体。
【实验反思】制得的气体中混有HCl的原因是 ;澄清石灰水始终不变浑浊又是因为 __ (用化学方程式表示)。
【拓展应用】若要除去CO2中混有的HCl和水蒸气,下列装置可以满足要求的是 。

化学兴趣小组利用中和反应测定某 溶液的浓度,实验过程如下:
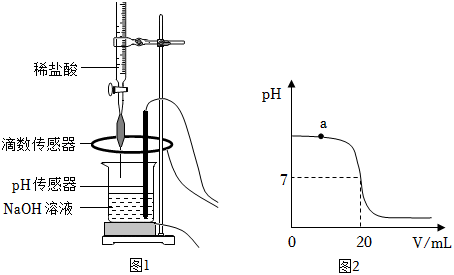
(1)配制稀盐酸:取 的浓盐酸,加水稀释成 的稀盐酸。所得稀盐酸中溶质的质量为_____;
(2)常温下,测定 溶液浓度:
Ⅰ.取 待测 溶液于烧杯中,按图1所示将上述稀盐酸滴入,通过数字化传感器同时测定滴入烧杯内盐酸的体积和烧杯内溶液的 ,得到如图2所示曲线。
Ⅱ.当 溶液与稀盐酸恰好完全反应时,所得溶液的 为_____。经计算,此时已滴入烧杯内的稀盐酸中,所含溶质的质量为 。
设 溶液中溶质的质量为 。
列出比例式__________
求解
答: 溶液中溶质的质量分数为 __________(列式并计算结果);
(3)写出a点对应的溶液中大量存在的分子、离子__________(用化学符号表示)。
某同学在学习质量守恒定律时,称取 镁条进行燃烧实验(如图)。
(1)计算:镁条完全燃烧生成氧化镁的质量(写出计算过程)。
(2)该同学称得反应后固体的质量小于 ,原因可能是_____。
二甲基亚砜( )工业废渣含 及少量有毒的 ,以该废渣为原料制备农用 ,既实现资源回收利用又保护了环境。工艺流程如下:

(1)农用 为农作物提供的营养元素有_______。
(2)步骤1的作用是除去 , 中氮元素的化合价为_______。
(3)结合溶解度曲线分析,步骤3“加热蒸发”时可控制只析出 固体,原因是_______。

(4)步骤4的操作是_______、过滤。
(5) 用量的估算依据是 (填标号)。
| A. |
与 的粒子个数比为 |
| B. |
与 的质量比为 |
| C. |
与 在溶液中的质量分数之比为 |
(6)该工艺所得农用 混有一定量 。取 样品加足量水溶解,向溶液中加入足量的 溶液,生成沉淀的质为 ,则样品中杂质 的质量是_____ ,样品含 _______ (质量分数)。
(相对分子质量: )
一班的同学在探究金属镁的化学性质时发现,将镁条放到盛有冷水的试管中,没有明显的现象,然后将试管放在酒精灯上加热,发现试管中有气泡产生。
(1)小明认为,据此现象可断定加热时镁能和水反应,小强认为小明的结论不正确,理由是 。
(2)小明向加热的试管中滴入酚酞溶液,溶液显红色,证明镁在加热时 (填"能"或"不能")与水发生反应
(3)小明将加热后的试管放置在空气中一段时间后,同学们发现溶液中的红色消失了。
在确定酚酞溶液没有变质的情况下,请你根据初中所学化学知识,对溶液中红色消失的原因做出合理猜想。
猜想一:
猜想二:
请设计实验方案,对其中一种猜想进行验证 。(只需答出实验方案,不需要回答现象和结论)
海洋中有丰富的水生生物和化学资源。海水晒盐能得到粗盐和苦卤,粗盐中含有多种可溶性杂质(氯化镁、氯化钙等)和不溶性杂质(泥沙等)。请回答下列问题。

(1)蒸发过程中使用到玻璃棒,其作用是 。
(2)若要去除粗盐中可溶性的杂质氯化镁和氯化钙,可依次加入过量的X和碳酸钠两种溶液。下列物质中,可作为X的物质有 。
A、KOH
B、Ba (OH) 2
C、Ca(OH) 2
D、NaOH
(3)操作Ⅱ后向所得滤液中加入适量的盐酸,其目的是 ,最后通过蒸发结晶得到较为纯净的氯化钠。