工业上常利用石灰浆[主要成分为Ca(OH)2]制备化工原料KClO3的流程如下:

已知:①反应1为:6Cl2+6Ca(OH)2 Ca(ClO3)2+5CaCl2+6H2O.
②有关物质在常温下的溶解度如下:
物质 |
Ca(ClO3)2 |
CaCl2 |
KClO3 |
KCl |
溶解度/g |
209.0 |
74.5 |
7.3 |
34.0 |
回答下列问题:
(1)在实验中两次涉及过滤操作,完成此操作需要的玻璃仪器有烧杯、玻璃棒、 ,该操作中玻璃棒的作用是 .
(2)Ca(ClO3)2的名称是 .对于反应1,参加反应的Cl2中有一部分Cl的化合价升高,另一部分降低,则化合价升高的Cl与化合价降低的Cl 的个数比为 .
(3)反应2为KCl与Ca(ClO3)2发生的复分解反应,该反应能发生的主要原因是 .溶液A中含有的溶质为CaCl2和 (填化学式).
(4)上述流程中析出的KClO3晶体表面通常吸附有Ca2+、Cl﹣等杂质离子,过滤时洗涤KClO3晶体,应选用下列中的 饱和溶液(填编号).
A.KCl B.CaCl2 C.KClO3 D.Na2CO3.
根据如图回答问题:
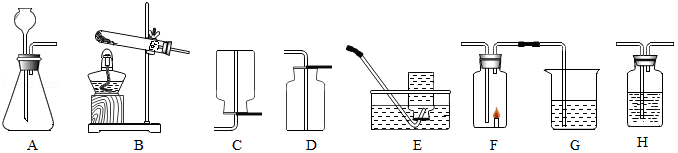
(1)实验室用高锰酸钾制取氧气的发生装置是 (填装置字母序号),该反应的化学方程式为 。
(2)选择气体收集方法时,必须考虑的气体性质有 (填序号)。
①颜色 ②密度和溶解性③可燃性
(3)某同学连接A、F、G进行实验,A中所加药品不同,G中所加药品相同,为Ca(OH) 2溶液。
①若实验时F中蜡烛熄灭,G中溶液变浑浊,则A中反应的化学方程式为 。
②若实验时F中蜡烛燃烧更旺,则A中产生的气体是 ,还需将气体通过盛有 (填药品名称)的洗气瓶H。
③若将G中的白色浑浊物从液体中分离出来的操作名称是 。
为了节约林木资源,近几年兴起了一种含碳酸钙的“石头纸”,这种“石头纸”是用沿海水产养殖中大量废弃贝壳制得的,为测定其中碳酸钙(杂质不溶于水也不与水反应)的含量。某校化学兴趣小组的同学进行了如下实验(水和氯化氢的挥发忽略不计);取25.0g样品粉碎放入烧杯中,加入一定质量分数的稀盐酸,所加稀盐酸的质量与生成气体的所量关系如图所示:
(1)计算“石头纸”中碳酸钙的质量分数。
(2)完全反应后烧杯内溶液的溶质的质量分数是多少?(结果精确到0.1%)

中国是把香椿当做蔬菜的唯一国家,它不仅营养丰富,而且具有极高的药用价值,如香椿中含有的皂甙,具有抗菌、防癌的作用,皂甙的化学式为C27H42O3,请你计算:
(1)皂甙属于 (填“有机物”或“无机物”);
(2)皂甙中各元素的质量之比是 (最简整数比);
(3)含氢元素8.4g的皂甙的质量为 克(写出计算过程)。
某校化学兴趣小组在学完碱的化学性质后,做了澄清石灰水和稀盐酸反应的实验,并将废液倒入一洁净的废液缸中,进行了如下探究:
探究Ⅰ:甲同学在做实验时没有观察到明显现象,于是对澄清石灰水和稀盐酸能否发生反应表示怀疑,乙同学认为,甲同学实验时应先向澄清石灰水中滴几滴酚酞试液,再滴加适量的稀盐酸,当观察到 时,就可以说明两种物质能发生反应。
探究Ⅱ:废液中溶质的成分是什么?
[做出猜想]
猜想一:CaCl2
猜想二:CaCl2、HCl
猜想三:CaCl2、HCl、Ca(OH)2
你的猜想:
丙同学认为猜想三是错误的,理由是 (用化学方程式解释)。
[实验设计]
|
设计者 |
实验操作 |
实验现象 |
实验结论 |
|
丁同学 |
取少量废液于一支试管中,向其中加入足量的碳酸钠溶液 |
有白色沉淀生成 |
猜想一正确 |
|
戊同学 |
取几粒锌粒于一支试管中,向其中加入少量废液 |
|
猜想二正确 |
[评价与反思]请判断以上设计的两个方案中, 同学的方案合理,请分析另一个方案不合理的理由: 。
[表达与交流]若实验证明猜想二是正确的,你认为该废液未经处理直接倒入下水道,可能造成的危害是 (填一点)。
通过近一年的化学学习,你已经掌握了实验室制取气体的有关方法,请根据图回答问题:
(1)以上装置A~F中有一处明显的错误,请加以改正 ;利用改正后的装置完成后面的实验;
(2)若选用装置B、D、G制取并收集干燥的二氧化碳气体,正确的组装顺序为 ,则在装置G中加入的液体试剂是 (填名称);
(3)实验室用高锰酸钾制取氧气,应选用的发生装置是 ,反应的化学方程式为 ;若用装置G收集氧气,气体从 (选填“a“或“b”)端通入;
(4)装置B、C都能用来制取氢气,相对于装置B,装置C的突出优点是 。