地壳中的元素分布(质量分数)如图,请回答下列问题。

(1)元素X是 ,由X与Y组成的化合物的化学式是 。
(2)地壳中的赤铁矿(Fe2O3)与CO高温反应可炼铁,其中Fe2O3发生了 反应(填“氧化”或“还原”)。
(3)如图是Si与Cl2反应生成SiCl4的图示,请在方框内补充所缺反应物的图示。

中国医学著作博大精深,许多化学物质很早就出现在了我国医书中。如李时珍的《本草纲目》中就有绿矾(FeSO4•7H2O)的相关记载。绿矾又名皂矾、青矾,性酸、凉、无毒,主要药用功能是除湿、解毒、收敛、止血。
(1)请写出铁与稀硫酸反应的方程式 。
(2)某实验小组欲用久置的硫酸亚铁溶液制备绿矾(FeSO4•7H2O)晶体,小明同学提出该硫酸亚铁溶液可能变质了,于是进行了以下探究活动:
[查阅资料]
①FeSO4易被空气中的氧气氧化成Fe2(SO4)3而变质。
②Fe2+在溶液中呈浅绿色,Fe3+在溶液中呈黄色。
③Fe3+的检验:向含Fe3+的溶液中滴加无色的KSCN(硫氰化钾)溶液,溶液会变为血红色。
[猜想与假设]猜想1:该硫酸亚铁溶液没有变质。
猜想Ⅱ:该硫酸亚铁溶液已经变质。
[设计实验并验证]
|
实验操作步骤 |
实验现象 |
实验结论 |
|
取少量样品于试管中,加入2﹣3滴 溶液 |
试管中溶液变成血红色 |
|
[实验拓展1]下列各组物质在溶液中能大量共存,且形成无色溶液的是 。
A.CuSO4、NH4Cl、Ba(OH)2
B.FeSO4、Na2SO4、KCl
C.FeCl3、NaOH、HCl
D.NaCl、MgSO4、KNO3
[实验拓展2]该实验小组继续查阅资料得知,单质铁能与硫酸铁溶液反应生成硫酸亚铁。于是向上述久置的硫酸亚铁溶液中加入过量铁粉,写出其中的化学方程式 。
下列是实验室制取和收集气体的装置图,据此回答下列问题
(1)仪器a的名称是 。
(2)实验室制取CO2应选用的发生装置是 ,用D装置收集CO2,气体应从 端通入(填“b”或“c”)
(3)写出一个实验室用B装置制取O2的化学方程式 。
(4)若用A装置作发生装置制取O2,常加入适量MnO2,其作用是 。
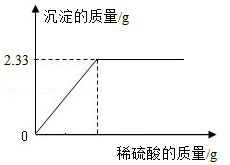
某NaCl样品中混有杂质BaCl2,为测定样品中BaCl2的质量分数,取固体样品10.0克完全溶解于水中,并向其中逐滴加入稀硫酸,实验过程中,产生沉淀的质量与加入稀硫酸的质量关系如图所示
(1)沉淀的化学式 。
(2)计算样品中BaCl2的质量分数(写出计算过程)
龙安柚是我市特产,其果肉含丰富的营养物质。下表列出的是每100g龙安柚可食用部分主要营养成分数据:
|
营养成分 |
水分 |
糖类 |
蛋白质 |
脂肪 |
钙、磷、铁 |
维生素 |
…… |
|
质量 |
84.8g |
10.3g |
0.7g |
0.6g |
84.9mg |
41.5mg |
…… |
(1)表中列出的营养成分“钙、磷、铁”是指 。
A.分子 B.元素 C.单质 D.原子
(2)蛋白质、糖类、脂肪、维生素均属于 。(填“无机物”或“有机物”)
(3)“抗坏血酸”又称维生素C,人体内缺乏维生素C会引起 。
A.坏血病 B.氟骨病 C.甲状腺肿大 D.食欲不振
(4)钙是人体内含量最高的金属元素,是构成人体的重要组分。儿童缺钙易患佝偻病和发育不良。缺钙者可以在医生的指导下口服葡萄糖酸钙溶液来补钙。如表为某品牌“葡萄糖酸钙口服溶液”的部分说明。
|
葡萄糖酸钙口服溶液 Calcium Gluconate Oral Solution [成分]本品每毫升含葡萄糖酸钙[(C6H11O7)2Ca]100mg(相当于钙9.3mg) [包装]每支装10mL,每盒12支。 |
葡萄糖酸钙的相对分子质量为430,请计算:
①葡萄糖酸钙中钙的质量分数为 。
②如果小明每天需摄入钙的量为1000mg,他通过食物的钙摄入量为721mg,你建议他每天应该服用该品牌口服液 支来补充钙摄入量的不足。
向54.5g某物质质量分数的盐酸溶液中加入4g氢氧化钠固体恰好完全反应,求所得溶液中溶质的质量分数。