实验室提供H2O2溶液、MnO2、KClO3和KMnO4四种药品及下列仪器。
(1)仪器⑤的名称为 。
(2)利用上述药品及仪器可以制取O2,反应的化学方程式是 ,组装发生和收集O2的装置,需要选择的最佳仪器是(选择序号填空) 。
在一堂化学实验课上,老师为每组同学分别提供了一瓶氢氧化钠溶液,让他们用1%的稀盐酸来测定其溶质的质量分数。以下是几组同学的设想及做法:
(1)甲组同学的实验如下图所示:在烧杯中加入5g氢氧化钠溶液,滴入几滴酚酞溶液,用滴管慢慢滴入1%的稀盐酸,并不断搅拌,至溶液颜色恰好变为无色为止。
请回答:
①酚酞溶液的作用是 ;
②边滴加稀盐酸,边要用玻璃棒不断搅拌的目的是 。
③当溶液颜色恰好变为无色时,共用去了稀盐酸7.3g,则甲组这瓶氢氧化钠溶液中溶质的质量分数为 (写出计算过程,结果用百分数表示)。
(2)乙组同学的设想是:在烧杯中加入一定量的氢氧化钠溶液,用滴管慢慢滴入1%的稀盐酸,并不断搅拌,通过用pH试纸多次测定溶液pH的办法,达到实验目的。
①下列使用pH试纸的方法正确的是 (填字母)。
| A.将pH试纸剪成几段节约使用 |
| B.将pH试纸直接插入待测液中 |
| C.将pH试纸放在干净的白瓷板上,用玻璃棒蘸取待测液滴在pH试纸上 |
| D.将pH试纸润湿后放在玻璃片上,用玻璃棒蘸取待测液滴在pH试纸上 |
②由于用pH试纸需多次测定,较繁琐,且所测数值不够精确。在老师指导下,乙组同学取了5g氢氧化钠溶液进行了数字化实验,由计算机描绘出了整个实验过程中溶液pH的变化图像(简单表示为下图)。
请回答:图中a点表示的含义是 ;b点溶液中含有的阳离子有 (填离子符号);乙组同学要计算出本组这瓶氢氧化钠溶液中溶质的质量分数,除了要用到已有数据外,你认为还需要的数据是 。
(3)丙组同学在滴加稀盐酸一段时间后,发现溶液中有少量气泡产生。这一“异常现象”激起了他们的探究欲望,通过实验证明:该组用的这瓶氢氧化钠溶液已经部分变质。
请用化学方程式表示其变质的原因 ;若要除去溶液中变质生成的杂质,请简要写出你的实验方案: 。
现有一定质量含有少量泥沙等不溶性杂质和少量Na2SO4,MgCl2,CaCl2等可溶性杂质的粗盐样品,某实验小组利用化学实验室常用仪器对粗盐样品进行提纯,提纯步骤如下:
请根据提纯步骤回答下列问题.
(1)步骤⑦的操作名称为 .
(2)请写出实验步骤②中所涉及的化学方程式 .
(3)步骤⑥中加入过量盐酸的目的是 .
(4)步骤②和步骤④ (填“可以”或“不可以”)颠倒,理由是 .
(5)检验步骤④中Na2CO3溶液已过量的方法是 .
(6)加碘食盐相关信息如图所示.
食盐中的碘酸钾(KIO3)在酸性条件下,可以将碘化钾(KI)变成碘(I2),化学方程式如下:
KIO3+5KI+6HCl=6KCI+3I2+3H2O
①向装有碘化钾和淀粉混合液的试管中,滴入稀盐酸将溶液酸化,再加入食盐,若食盐中有碘化钾,则加入食盐后的实验现象 .
②小强同学欲测定加碘盐中碘元素的质量分数,实验步骤如下:取10g食盐样品于试管中加水溶解,加入过量KI的和淀粉混合溶液,再滴入稀盐酸将溶液酸化使其充分反应后,调节溶液呈中性,再向试管中滴加硫代硫酸钠溶液(Na2S2O3),发生化学反应方程式为:2Na2S2O3+I2═Na2S4O6+2NaI
当加入质量分数为0.237%Na2S2O3溶液2g时,I2恰好反应完全,通过计算判断该食盐样品是否合格(已知Na2S2O3的相对分子质量为158.请写出计算过程).
实验室使用块状石灰石(CaCO3)和稀盐酸制CO2,当观察不到有气泡产生,固体仍有剩余时,通常认为反应结束,剩余液呈中性。某兴趣小组对此进行了以下探究:
【实验操作】(1)向试管中加入5粒石灰石,倾倒约试管体积1/3的稀盐酸(1:1);观察不到气泡后,仍有固体剩余;将试管静置。
(2)取上层清液,用pH试纸测得溶液pH=2,说明溶液显_______性;
pH测定中,“上层清液滴到试纸上”的后一步操作是_______________。
【实验思考Ⅰ】反应剩余液中有哪些物质?其中能使溶液pH=2的有哪些?
【实验探究Ⅰ】(1)甲同学通过实验排除了CaCl2的可能性。简述其实验方案___________。
(2)乙同学将CO2通入蒸馏水中至饱和,测得pH>5,。
(3)综合甲、乙两同学实验,得出的结论是:剩余液中还含有_______________。
【实验思考Ⅱ】试管中剩余固体是否仍含有CaCO3?
【实验探究Ⅱ】小组同学向试管中继续加入稀盐酸(1:1),又有大量气泡产生。
(1)由此得出的结论是______________;写出反应的化学方程式_______________________。
(2)比较稀盐酸加入前后的实验现象,解释“又有大量气泡产生”的原因:_________________。
【拓展延伸】(1)反应剩余液放置一段时间后,溶液pH增大,其主要原因是_________。
(2)假如用100g14.6%的稀盐酸和足量的石灰石反应,看不到气泡产生时,停止收集气体。收集到的CO2质量_______(选填“>”、“<”、“=”)8.8g。
乙炔(C2H2)气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割或焊接金属。乙炔由碳化钙(块状固体,化学式为CaC2)与水反应生成,同时生成一种白色固体。
【提出问题】白色固体是什么物质?
【做出猜想】小明经过思考认为有以下几种可能:
猜想一:CaO;猜想二: ;猜想三:Ca(OH)2。
他的依据是 。
【交流反思】经过同学们交流讨论,认为猜想一不成立。否定猜想一的理由是: 。
【进行实验】
(一)取少量白色固体放入试管中,滴加稀盐酸,没有观察到 ,证明猜想二不成立。
(二)取少量白色固体加入到水中,取上层清液, ,有白色沉淀出现,证明猜想三成立。该反应的化学方程式为: 。
结论:白色固体是Ca(OH)2。
【拓展应用】已知碳化钙与水反应非常剧烈,乙炔的密度比空气略小。实验室欲制取并收集纯净的乙炔,要求做到节约、安全、随时发生、随时停止,你选择的装置是 (选填图中装置序号)。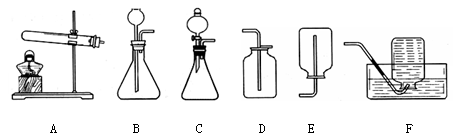
氢氧化钠是一种重要的化工原料。
(1)氢氧化钠俗称__________。
(2)利用下图所示装置(固定装置省略)进行NaOH与CO2气体反应的实验。若A与C连接,将分液漏斗中部分NaOH溶液注入烧瓶中,然后关闭活塞并打开止水夹,观察到的实验现象是________________;CO2与NaOH溶液反应的化学方程式是_____________________________________。
(3)已知: Na2CO3+H2O+CO2=2NaHCO3; NaHCO3+NaOH=Na2CO3+H2O
将(2)中实验后烧瓶内的溶液在低温下蒸干得到白色固体X,则X的组成可能有四种情况,分别是:
Ⅰ.NaOH,Na2CO3;
Ⅱ.____________;
Ⅲ.______________;
Ⅳ.NaHCO3
(4)根据以上信息,请设计一种以100mL未知浓度的NaOH溶液和CO2气体为原料获得Na2CO3溶液的方法__________________________________________________。