小明取酸性锌锰干电池进行研究,他发现电池内部结构如图1所示。
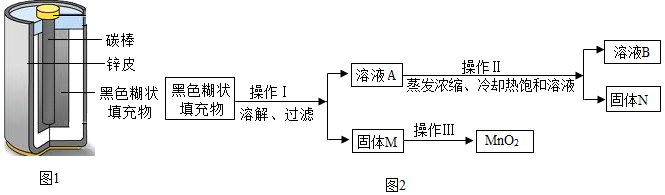
【查阅资料】(1)锌皮为金属锌(含有少量的铁)
(2)黑色糊状填充物由炭黑、MnO2、ZnCl2和NH4Cl等组成
(3)有关数据见下表
温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
溶解度/g |
NH4Cl |
29.3 |
37.2 |
45.8 |
55.3 |
65.6 |
77.3 |
ZnCl2 |
343 |
395 |
452 |
488 |
541 |
614 |
|
【实验探究一】小明取适量黑色糊状填充物,按如图2所示实验流程进行探究。
(1)溶液A中溶质主要有 (填化学式),操作Ⅱ中采用冷却热饱和溶液的方法实现两者分离的依据是 。
(2)欲从固体M中得到较纯的MnO2,操作Ⅲ可采用简便方法是 。
【实验探究二】小明取电池外壳锌皮,用砂纸打磨干净,剪成小块,进行实验。
(1)取一块锌皮放入盛有适量稀盐酸的烧杯中,有ZnCl2生成。
①实验中可观察到的现象是 ;该反应属于基本反应类型中的 反应。
②下列各组物质混合后,也能生成ZnCl2的有 (填字母序号)。
A.ZnO与稀盐酸
B.ZnSO4溶液与BaCl2溶液
C.ZnCO3与NaCl溶液
D.Zn(NO3)2溶液与NH4Cl溶液
(2)另取一块锌皮放入盛有一定量CuSO4溶液的烧杯中,充分反应后得到溶液E和固体F.当溶液E中只含有一种溶质时,该溶质是 (填化学式);当固体F中只含一种物质时,溶液E中最少含有 种溶质。
(3)若将6.5g锌皮与足量稀硫酸完全反应,则生成氢气的质量 0.2g(选填“<”、“=”或“>”)。
牙膏中常用碳酸钙、二氧化硅等物质作为摩擦剂.某同学对牙膏中摩擦剂碳酸钙的含量进行探究.
【实验原理】测定C装置中生成的BaCO3沉淀的质量,通过计算确定牙膏中CaCO3的质量分数.
【查阅资料】CO2+Ba(OH)2=BaCO3↓+H2O,牙膏中其他成分遇到盐酸时无气体产生.
【实验装置】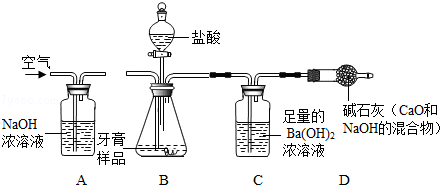
根据探究过程回答下列问题:
(1)装置B中发生反应的化学方程式 ;
(2)实验过程中需持续缓缓通入空气,其作用有:①搅拌B、C 中的反应物,使其充分反应;② ;
(3)从C中过滤出BaCO3沉淀所需的玻璃仪器有烧杯、 和玻璃棒;
(4)实验中准确称取三份牙膏样品,每份4.0g,进行三次测定,测得生成BaCO3的平均质量为1.97g.则样品中CaCO3的质量分数为 ;
(5)若没有A装置,直接通入空气,则测得CaCO3的质量分数 (填“偏大”、“偏小”或“不变”).
请根据下列装置回答问题:
(1)写出标号仪器名称:a ;b .
(2)实验室制取二氧化碳的化学方程式为 ,其发生装置是 (填字母,下同),收集装置是 .
(3)装置A中的试管口应略向下倾斜的原因是
(4)连接完B装置后应 ,用该装置制取氧气的化学方程式是 ,该反应的基本类型是 反应.
同学们在帮助老师整理实验室时,从1、2号橱窗中发现了两瓶失去标签的黑色粉末药品,并确定了这两瓶黑色粉末是木炭粉、铁粉、氧化铜、高锰酸钾中的两种。他们继续进行了分析、试验和反思:
【查阅资料】CuO、Fe2O3等金属氧化物与酸反应,生成盐和水
(1)分析:小燕同学认为一定不是高锰酸钾,原因是_______________________;
(2)实验一:
| 实验操作 |
||
| ①取一种黑色粉末少许,加入到稀硫酸中 |
黑色粉末溶解,溶液颜色变_________ |
此粉末是氧化铜 |
| ②取另一种黑色粉末少许,加入到稀硫酸中 |
黑色粉末不溶解,没看到气体产生 |
此粉末一定不是铁粉 |
(3)反思:小华同学认为不做实验①,运用逻辑推理的方法也能得出其中之一是氧化铜的结论,原因是:__________________________________________________;
(4)实验二:他们又进行了如下实验:将两种黑色粉末混合加热(实验装置如下图),发现黑色粉末逐渐变_______,澄清石灰水变____________。写出两种黑色粉末发生反应的化学方程式__________________。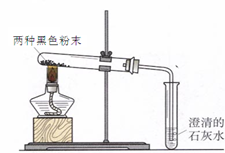
一男孩在排污井盖上燃放鞭炮,点燃了排污井内的气体,井盖被炸飞,男孩被井盖击伤.
【提出问题】排污井内气体的主要成分是什么?
【查阅资料】排污井内的有机物在一定的条件下发酵产生了气体,其成分可能含有CO、CO2、CH4等.
【提出猜想】某兴趣小组同学对排污井内气体含有上述气体中最少2种成分的猜想如下:
猜想Ⅰ:有CO2、CH4猜想Ⅱ:有CO、CH4
猜想Ⅲ:有CO、CO2猜想Ⅳ:有CO、CO2、CH4
【实验方案】小组同学共同设计了下图所示的装置并经行探究.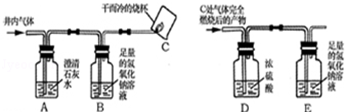
【问题讨论】
(1)装置A出现浑浊,证明猜想 不正确.
(2)小明通过装置C处 的现象,证明猜想Ⅲ不成立.小芳对此提出了疑义,小芳认为要
在 位置,再增加一个上图中 (填序号)装置,才能证明猜想Ⅲ不成立.
(3)为了进一步确认气体中是否含有一氧化碳,小明将装置C处气体完全燃烧后的产物依次通过装置D、E,经实验测定装置D增重1.8g,装置E增重2.2g,由此证明猜想 成立.
(4)小明认为要证明排污井内气体是否含有CO,可以不用装置B,小芳则认为需要使用装置B,你认为装置B的作用是 .
科学家设想利用太阳能加热器“捕捉CO2”、“释放CO2”,实现碳循环(如图所示)。
某化学小组的同学对此非常感兴趣,在老师的指导下,设计如下装置探究上述设想的反应原理是否可行。
(1)能证明装置A“释放CO2”的现象是 ;
(2)装置B在实验结束撤掉酒精喷灯时的作用是 ;
(3)上述反应结束后,小组同学对D中固体的成分进行探究,以证明是否“捕捉”到CO2。
【猜想与假设】
D中的固体可能为:I.只有氧化钙;Ⅱ.氧化钙与碳酸钙;Ⅲ.只有碳酸钙
【进行实验】
①甲同学从D中取一定量的固体于试管中,并加入一定量的水,振荡,有白色不溶物。甲同学据此认为试管中的固体为碳酸钙,即猜想Ⅲ成立。乙同学认为上述实验不足以证明猜想Ⅲ成立,其理由是 。
②乙同学从D中取一定量的固体于试管中,加入一定量的水,触摸试管外壁,感觉发热;继续向试管中加入几滴稀盐酸,没有发现气泡产生。乙同学据此认为试管中的固体只有氧化钙,即猜想I成立。丙同学认为乙的实验不足以证明猜想I成立,理由是 。
③丙同学认为利用感觉温度变化的方法判断是否有氧化钙不可靠,他用水、酚酞试液和稀盐酸证明了猜想Ⅱ成立,请完成他的实验报告。
| 实验步骤 |
实验现象 |
实验结论 |
| 猜想Ⅱ成立 |
(4)通过以上探究,小组同学认为科学家的设想在反应原理上是可行的。该设想的优点有 (填字母序号)。
A.原料易得
B.充分利用太阳能
C.释放出的CO2可作为资源加以利用