碱式碳酸镁[Mg2(OH)2CO3]和过氧化镁(MgO2)都是重要化工原料。
Ⅰ.以Mg2(OH)2CO3为原料,制备产品MgO2的步骤如下:
(1)煅烧:煅烧Mg2(OH)2CO3得到三种氧化物,其中一种常温下是气体,且能使澄清石灰水变浑浊,煅烧时反应的化学方程式为 。
(2)转化:向所得固体中加双氧水充分搅拌,发生反应MgO+H2O2=MgO2+H2O,温度升高,说明该反应 热量(填“放出”或“吸收”)。其他条件相同,煅烧温度、煅烧时间不同,所得MgO对MgO2产率(产率= ×100%)的影响分别如图1所示,则最佳的煅烧温度为 ℃、煅烧时间为 小时。
×100%)的影响分别如图1所示,则最佳的煅烧温度为 ℃、煅烧时间为 小时。

(3)分离:得到产品。
(4)测定:假设产品中仅少量MgO,某小组设计图2装置,通过测定生成O2体积,计算MgO2的质量分数。
已知:a.MnO2与稀盐酸不反应 b.MgO2+2HCl=MgCl2+H2O2
c.2MgO2 2MgO+O2↑ d.MgO+C
2MgO+O2↑ d.MgO+C Mg+CO↑
Mg+CO↑
①仪器M的名称是 ,MnO2的作用是 。
②相同条件下, 能使测定结果更准确。(填图2中“装置A”或“装置B”)
③实验室用溶质质量分数为37%、密度是1.18g•mL-1的浓盐酸配制10%的稀盐酸110g,需要水 mL.(水的密度是1g•mL﹣1,计算结果保留一位小数)
④经讨论,该小组又设计了下列3种方案,分别取5.0g产品进行实验,能确定MgO2质量分数的是 。(填序号)
a.加热,使MgO2完全分解,测出剩余固体的质量
b.与足量炭粉在高温下充分反应,测出生成Mg的质量
c.先加足量稀盐酸,再加足量NaOH溶液,充分反应,测出Mg(OH)2质量
Ⅱ.MgCl2是制备Mg2(OH)2CO3的原料,现用含碳酸镁84%的菱镁矿制备MgCl2,反应如下:MgCO3+Cl2+CO MgCl2+2CO2(设杂质不参加反应)。生产19吨MgCl2需要这样的菱镁矿多少吨?(写出计算过程)
MgCl2+2CO2(设杂质不参加反应)。生产19吨MgCl2需要这样的菱镁矿多少吨?(写出计算过程)
2016年11月3日,我国大推力运载火箭长征五号发射成功,我国具备了建造空间站的能力。
(1)空间站里的氧气主要来自电解水。电解水时,氧气在电极的 极产生。产生的氢气与分离出的二氧化碳在催化剂的作用下反应,生成水和甲烷,该反应的化学方程式为 。
(2)为了能将沉重的空间站各舱段送上太空,长征五号的箭芯采用液氢作燃料,主要是因为氢气燃料具有 的优点。
(3)火箭整流罩用玻璃钢做外壳,玻璃钢属于 材料。用它做外壳是利用其哪些优良性能 (答一条即可)。
(4)长征5号的助推器用液氧煤油作推进剂。
①航天煤油可由优质石油分离而来,这是利用石油中各成分的 不同进行分离。
②我国适合炼制航天煤油的石油非常少。目前已经实现通过煤的液化制取优质航天煤油。煤液化制煤油发生的是 (填“物理”或“化学”)变化。

实验室有一份部分被氧化成氧化镁的镁粉样品,未知浓度盐酸和40%的氢氧化钠溶液,兴趣小组同学为分析样品中金属镁的质量分数含量和计算盐酸的质量分数,进行如下探究:
(1)用盐酸溶解样品(样品混合均匀),测定生成氢气质量,实验数据如表所示:
|
实验序号 |
所取样品质量(g) |
所加盐酸质量(g) |
生成氢气质量(g) |
|
Ⅰ |
16.0 |
60.0 |
0.5 |
|
Ⅱ |
16.0 |
130.0 |
1.0 |
|
Ⅲ |
16.0 |
150.0 |
1.0 |
镁粉样品中金属镁的质量百分含量为 。
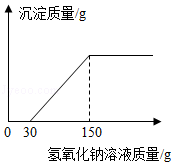
(2)向实验Ⅲ后的溶液中加入40%的氢氧化钠溶液,生成沉淀的质量随加入氢氧化钠溶液质量的变化关系如图所示。计算盐酸的质量分数。(写出计算过程)
实验室有一份氯化钠和氯化钡混合物样品。兴趣小组同学设计了如下实验方案,分离提纯氯化钠并测定样品中氯化钠的质量百分含量,请回答下列问题:
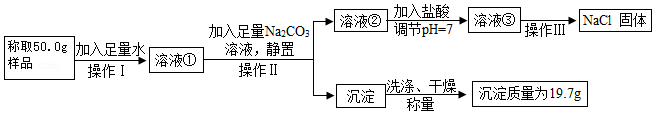
(1)用托盘天平称量样品前对天平进行的第一步操作是 。
23溶液的目的是 。该小组同学用如图所示装置进行操作Ⅱ,请指出操作中存在的两处错误: 、 。
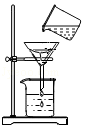
(3)下列关于操作Ⅲ的说法正确的是 (填序号)。
a.该操作中用到的玻璃仪器有酒精灯、玻璃棒、蒸发皿
b.该操作中用玻璃棒不断搅拌的目的是防止局部温度过高,造成液滴飞溅
c.当蒸发皿中出现较多固体时,停止加热
d.停止加热后,立即将蒸发皿直接放在试验台上。
(4)样品中氯化钠质量百分含量为 。
测定抗酸药物有救成分的含量胃酸的主要成分为盐酸,胃酸太多导致胃不舒服时,可以考虑服用抗酸药物来中和胃酸.某抗酸药物的有效成分为氢氧化镁,为测定氢氧化镁的含量,小霞同学取一片该药物(规格为lg)于烧杯中,加入20g溶质质量分数为3.65%的稀盐酸,恰好完全反应(假设药物中其他成分可溶于水,但不与盐酸反应).
(1)通过已知数据能求出的量有 (填字母编号,符合题意的选项都选).
A.每片药物中氢氧化镁的含量 B.反应中生成氯化镁的质量
C.反应后溶液中氯化镁的质量分数 D.20g稀盐酸中水的质量
(2)计算1g该药物中含氢氧化镁的质量(要求写出计算过程).
探究白酒燃烧的奥秘
在诊所里,小华同学看到老中医用“酒火疗法”为患者治疗,发现白酒竟然能够被点燃。老中医告诉她:只有酒精体积分数较大(即度数较高)的白酒才能被点燃。好奇并喜欢探究的小华用体积分数为75%的酒精溶液(指每100mL酒精水溶液中含75mL酒精)
代替白酒进行了系列探究。
【提出问题】能被点燃的酒精溶液的最小体积分数是多少?
【查阅资料】
①酒精( C2H5OH)是一种无色液体,易挥发,易燃烧,可任意比例与水互溶。
②两种液体混合时,分子间隔不同对混合后的总体积有影响,但对本实验的影响很小,
忽略不计。
【实验探究】
实验用品:75%酒精溶液、蒸馏水、小烧杯、胶头滴管、量筒(20mL、10mL)、蒸发皿、玻璃棒、火柴。
(1)实验时,用75%酒精溶液配制10mL 60%的酒精溶液。
①最好选用 mL量筒,使用量筒量取液体读数时应注意 。
②配制该溶液的操作方法是 。
(2)在室温(20℃)时,小华按上述方法配制了体积分数为50%、40%、30%、20%的酒精溶液各l0mL,分别倒入蒸发皿中,点燃,观察。实验结果如下表
|
酒精体积分数 |
50% |
40% |
30% |
20% |
|
观察到的现象 |
可燃 |
可燃 |
不可燃 |
不可燃 |
酒精完全燃烧的化学方程式为 。
(3)室温(20℃),在小华实验探究的基础上,要想更精确测定能被点燃的酒精溶液的最小体积分数,请你补充进一步探究的实验方案 。
(4)拓展应用
①未盖灯帽且久置不用的酒精灯,常常不能被点燃。其原因是 。
②因酒精含量低而不能燃烧的酒精溶液,要分离出其中的酒精,可采用的方法是 。