已知某混合气体由H 2、CO和CO 2三种气体组成。为验证该混合气体成分,科学研究小组的同学经过讨论,设计了如图1所示的实验方案。

根据方案回答下列问题:
(1)装置C在实验中的作用是
(2)仅根据D装置中黑色粉末变红这一现象,能否证明混合气体中一定存在CO?请判断并说明理由
(3)小丁根据装置E中出现白色硫酸铜粉末变成蓝色的实验现象,得出该混合气体中有氢气存在的结论。你认为结论是否可靠?若可靠,请说明理由;若不可靠,请对图1实验装置提出改进意见
(4)图1方案B装置可用来吸收CO 2但没有现象。为证明CO 2和NaOH能发生反应,小丁又设计了图2所示的方案。则图2方案中所加试剂X应该是 。
铜制品长期露置在潮湿的空气中会因锈蚀生成“铜绿”[化学式为 ]而使其表面变成绿色。
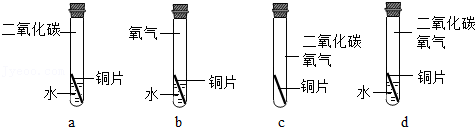
(1)小花同学根据铜绿成分做出猜想:金属铜锈蚀的条件除了有氧气和水外,还必须有二氧化碳,为了证明“必须有二氧化碳”,需要进行下列实验中的 _____(选填实验编号)。
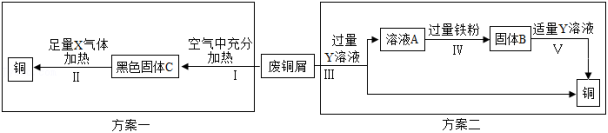
(2)小花和同学们利用废旧品中锈蚀严重的废铜屑为原料(假设不含其他杂质)设计了两个方案回收铜。
【查阅资料】a.

b.
【分析评价】
①X为碳的氧化物时,步骤Ⅱ中发生反应的化学方程式为_____________。
②步骤Ⅴ过程中观察到的实验现象为____________________。
③以上两个方案中,你认为哪一个方案更优越并说明理由__________(理由写一点)。
【拓展探究】
(3)氢气也能将氧化铜还原为铜。小红和小强各取 氧化铜用氢气还原,反应一段时间后,两份固体均全部变红。小红和小强所得红色固体质量分别为 和 。
提出问题:红色固体中含有哪些物质?
查阅资料:c.氢气还原氧化铜时也可产生氧化亚铜( )。
d.氧化亚铜为红色固体,在空气中溶于氨水得到蓝色溶液。
分析推断:小红得到的红色固体中含有的物质为_____(填化学式)。
实验检验:请设计简单实验检验小强得到的红色固体的成分 __________________________________________________。
如图为实验室常用的实验装置,请回答:

(1)写出标号仪器的名称:①_____,②_____。
(2)实验室常用一种固体和一种液体制取氧气,该反应的化学方程式为____________________,氧气能用 装置收集是因为氧气 _____溶于水。
(3)若用 装置干燥二氧化碳气体, 装置中应盛装的试剂为_____。
(4)氯气是一种有毒的气体,密度比空气大,能溶于水并与水发生反应。实验室常用浓盐酸和二氧化锰共热制取氯气。为了便于连接尾气处理装置,实验室制取并收集氯气应选择的装置为 _____(填装置序号)。
掌握实验室制取气体的方法是初中生必备的实验技能。如图是制取气体的常用装置,回答下列问题。

(1)仪器a的名称为_____。
(2)实验室制取氧气,可选择的发生装置和收集装置是__________(写一种组合),该反应的化学方程式为_________________________。
(3)用装置D收集二氧化碳时,其验满的方法是_________________________。
化学是一门以实验为基础的科学。回答下列问题:
(1)实验室中常见的气体发生装置及收集装置如图。

①选用装置 制取气体时,对药品和反应条件的要求是_______________。
②仪器 的名称是_____,实验时为防止气体从该仪器的上口逸出,应采取的措施是__________。
③铁和稀盐酸反应制取氢气的化学方程式是__________,若用排空气法收集氢气,气体应从装置 的_____(填“b”或“c”)端进入。
(2)向试管中加入 蒸馏水,滴入 滴石蕊溶液(图Ⅰ),按图Ⅱ、Ⅲ依次进行实验。

①Ⅲ中观察到的实验现象是_____。
②由于 的干扰,该实验不能直接证明使石蕊溶液变色的物质一定是 。设计实验方案排除 的干扰 _________________________。
某化学兴趣小组研究影响化学反应快慢的因素。
(1)下图是实验室中常用的仪器

①仪器A的名称是_______。
②从上图中选择合适的仪器组装一套 发生装置,要求添加盐酸无需拆开装置,需要用到的仪器有哪些?_______(填标号)
(2)该小组的实验设计和数据记录如下表。每个实验均在反应开始后,就立即用排水法连续收集多瓶 ,表中“—”表示气泡太少,不再收集。
|
序号 |
反应物 |
收集每瓶气体所用时间(单位:秒) |
|||||||
|
盐酸 浓度 |
盐酸 体积 |
大理石 形状 |
第1瓶 |
第2瓶 |
第3瓶 |
第4瓶 |
第5瓶 |
第6瓶 |
|
|
实验1 |
|
|
小颗粒 |
|
|
|
|
|
|
|
实验2 |
块状 |
|
|
|
|
|
|
||
|
实验3 |
|
|
小颗粒 |
|
|
|
|
|
|
|
实验4 |
块状 |
|
|
|
|
|
|
||
|
实验5 |
|
|
小颗粒 |
|
|
|
|
|
— |
|
实验6 |
块状 |
|
|
|
— |
— |
— |
||
①该小组研究了哪些因素对反应快慢的影响?_______
②为了分析浓度对反应快慢的影响,可对比表中实验_______(填标号)。
| A. |
|
B. |
|
C. |
|
D. |
|
③根据实验数据反映出的规律,表中数值 的合理范围是:_______< <_______。
(3)该小组在反应开始后立即收集第1瓶气体,你认为该做法合理吗?说出你的观点并阐述理由。__。