镉是重金属污染中最受关注的元素之一。已有研究表明,秋华柳对镉具有较强的耐受和富集能力。为研究秋华柳受镉污染时,体内金属元素含量的变化。选取生长基本一致的幼苗,在不同镉离子浓度的土壤中进行分组实验。18天后测量植株各部分金属元素的含量,结果如图。

(1)由图可知,秋华柳叶片铁元素含量与镉离子浓度的关系是 。
(2)由实验结果可知,秋华柳 的变化可作为其受镉污染程度的指示。
(3)对镉污染土壤进行治理可采用化学沉淀法,即将土壤溶液中的镉离子形成沉淀物而降低污染。已知氯化镉易溶于水,碳酸镉和氢氧化镉难溶于水。下列物质可用于处理土壤镉污染的是 。
| A. |
氢氧化钠 |
B. |
氢氧化钙 |
C. |
碳酸钙 |
D. |
氯化钠 |
如图是实验室制取气体的相关装置,请回答下列问题。

(1)①仪器的名称是 。
(2)实验室用高锰酸钾制取氧气。若要收集一瓶较纯净的氧气,应选择的发生装置和收集装置是 (填装置对应的字母,下同)该反应的化学方程式是 ,反应的基本类型是 。
(3)实验室制取二氧化碳,应选择的发生装置是 。若用C装置收集二氧化碳气体,验满方法是 。
实验小组将澄清石灰水和碳酸钾溶液混合,充分反应后过滤,得到了滤液M,同学们对滤液M中溶质的成分进行探究,探究过程如下:
【猜想与假设】①含有KOH;②含有 ;
③含有KOH、K 2CO 3; ④含有KOH、K 2CO 3和Ca(OH) 2。
【设计与实验】
(1)大家认为猜想 一定不正确,其原因是 。
(2)甲同学取滤液M样品,向其中加入足量的 ,不产生气泡,则猜想③不正确。
(3)乙同学依据甲同学的实验结论继续实验,记录如下:
|
实验操作 |
现象 |
结论 |
|
取一定量滤液M于试管中,加入 溶液 |
|
猜想②成立 |
相关反应的化学方程式为 。
【交流与反思】
若将滤液M直接倒入下水道,对环境造成的影响是 。
化学是一门以实验为基础的科学,根据如图所示的实验,请回答下列问题。
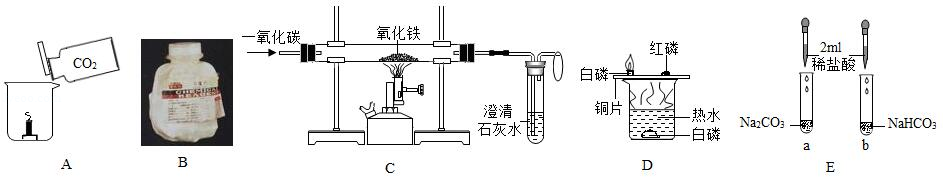
(1)A图烧杯中的短蜡烛熄灭,体现二氧化碳的物理性质是 ;
(2)B图中装满生石灰的塑料试剂瓶已经膨胀破裂,请用文字解释这一现象 ;
(3)C图玻璃管中的现象是 ,该现象体现了一氧化碳的性质是 ;
(4)D图所示铜片上的白磷燃烧,而红磷不燃烧,证明燃烧需要的条件之一是 ;
(5)E图中,A、B两试管中各盛有0.5g碳酸钠和碳酸氢钠,分别加入2mL等浓度的稀盐酸,观察到 (填"A"或"B")试管中的反应更迅速。
实验室制取气体时需要的一些装置如图所示,请回答下列问题。

(1)写出标有序号的仪器名称:① ;
(2)实验室用大理石和稀盐酸制取二氧化碳可选择的发生和收集装置为 (填字母序号),其反应的化学方程式为 ,该发生装置中使用分液漏斗的优点是 ;
(3)写出检验二氧化碳是否集满的操作方法 ;
(4)若用(2)中所选装置来制取干燥的氧气,还需要的装置为 (填字母序号)。
(5)某兴趣小组的同学用A、G、H装置进行实验,若实验时G装置中蜡烛燃烧更剧烈,H装置中的现象是 ,A装置中反应的化学方程式为 。
工业采用电解氯化钠溶液制备烧碱。某同学取电解后的溶液进行如下探究:
【提出问题】电解后的溶液中的溶质是什么?
【猜想假设】(1)NaOH、NaCl(2)NaOH
【实验探究】取电解后的溶液,进行如下实验:

【收集证据】实验1的反应现象为(1) ,实验2发生反应的化学方程式为(2) 。
【实验结论】电解后的溶液中的溶质是(3) 。
【表达交流】实验中滴加酚酞溶液的作用是(4) 。在滴加过量稀硝酸的过程中,图2中①表示的是(5) (填符号),②表示的是(6) (填符号)。
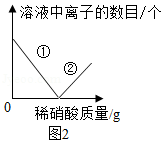
【总结规律】通过探究还可认识到:上述实验1和实验2的反应都是两种化合物在溶液中(7) 的形式,通过一种(8) 的方式而发生的复分解反应。