漳州小吃手抓面,制作时要用发到大树碱,大树碱的主要成分是K 2CO 3.为了测定大树碱中K 2CO 3的质量分数,小文同学进行了如下实验;
(1)用托盘天平称取10g大树碱样品,在称量过程中发现天平指针如图所示,则此时应进行的操作是 .
(2)用量筒量取一定量的水,为了准确量取水的体积,还需要使用的仪器是 .
(3)把大树碱样品和水加入烧杯中,用玻璃棒搅拌,使大树碱完全溶解,玻璃棒的作用是 .
(4)向配好的溶液中逐渐加入CaCl 2溶液,生成1g沉淀(假设大树碱中其它成分不参与反应,反应的化学方程式为CaCl 2+K 2CO 3═CaCO 3↓+2KCl).计算大树碱中K 2CO 3的质量分数?(要写出计算过程)
(5)小文同学在配制好溶液后,发现纸片上还有残留固体,则计算出的大树碱K 2CO 3的质量分数 (填"偏大"或"偏小")

为测定一标签破损(如图)的钙片中碳酸钙的含量,某同学做如图实验:取10片钙片,放入干燥、洁净的烧杯中,然后逐滴滴加稀盐酸,当加入50g盐酸后,恰好完全反应,此时称量烧杯内剩余物质的总质量为65.6g(钙片中其他成分不和稀盐酸反应,反应中产生的气体全部放出).
(1)反应中生成 g二氧化碳,该钙片中碳酸钙的质量分数为 ;
(2)试计算所用稀盐酸中HCl的质量分数.

做完氢氧化钠与稀硫酸中和反应的实验后,兴趣小组的同学对反应后溶液中溶质的成分进行了探究,请和他们一起探究并完成以下各空;
[提出问题]溶液中溶质的成分是什么?
24;
24和 两种物质;
24和NaOH两种物质。
[实验验证]
|
实验操作 |
实验现象 |
实验结论 |
|
|
甲同学实验 |
取适量中和反应后的溶液滴于试管中,将表面打磨后的铝片放入试管的溶液中 |
铝片逐渐溶解,并有大量气泡冒出 |
猜想(2)成立 |
|
乙同学实验 |
取中和反应后的溶液少许于另一试管中,并滴加几滴无色酚酞试液 |
溶液变 色 |
猜想(3)成立 |
丙同学对甲、乙两同学结论不同产生质疑。
242)和氢气,反应的化学方程式为2Al+2NaOH+2 H2O 22↑。
[交流反思]①丙同学肯定猜想(1) (填“成立”或“不成立”);
②丁同学认为猜想(2)不成立,其理由是 ;
③该组同学经过充分讨论,一致认为猜想(3)成立;
④甲同学的实验是铝片和 溶液反应。
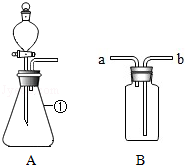
通过近一年的化学学习,你已经掌握了实验室制取气体的有关方法,请根据图回答问题:
(1)仪器①的名称是 2和 ;
(2)连接好装置后,必须首先 ;
(3)用排水法收集氧气,可在B装置中装满水后,是氧气从 口进入(填“a”或“b”);应将收集满氧气的集气瓶正放在桌面的原因是 .
已知某溶液中的溶质可能是HCl、NaOH、CaCl 2中的一种或两种,为确定该溶液中溶质的成分及含量,进行以下实验。
(1)取少量溶液与试管中滴入2滴无色酚酞,酚酞不变色,溶液中一定不存在 。
(2)为了进一步测定成分及含量,重新取120g溶液于烧杯中,逐滴加入20.0%的Na 2CO 3溶液,测得滴加溶液的质量与产生沉淀的关系(图1)和滴加溶液的质量与烧杯中溶液的pH关系(图2)。
(已知:向盐酸中滴加碳酸钠溶液发生反应为:Na 2CO 3+2HCl=2NaCl+H 2O+CO 2↑;CaCl 2溶液呈中性。)回答下列问题:

①该溶液中溶质的化学式为 。
②计算溶液中各溶质的质量分数。(写出计算过程)
③m 1= g;m 2= g。
用砂纸打磨过的镁条与稀盐酸反应时,现象为:反应剧烈,产生大量气泡,且试管明显发热,但是,在分组实验中,部分小组除观察到上述现象外还看到:出现白色不溶物。
【提出问题】分组试验中,为什么有的小组出现白色不溶物?
【实验探究一】在4支试管中加入等量、同浓度的稀盐酸,加入宽窄相同、用砂纸打磨过的镁条,反应后静置观察,结果如下表:
|
试管 |
A |
B |
C |
D |
|
镁条长度 |
1cm |
2cm |
3cm |
4cm |
|
不溶物 |
无 |
少量 |
较多 |
很多 |
【实验结论】出现白色不溶物是因为 。
【提出问题二】分组实验中,出现的白色不溶物是什么?
【查阅资料】
①在MgCl 2溶液中,MgCl 2能发生微弱水解,反应为:MgCl 2+2H 2O=Mg(OH) 2+2HCl或MgCl 2+H 2O=Mg(OH)Cl+HCl;加热能促进水解反应的进行。
②AgNO 3与可溶性氯化物在溶液中可发生复分解反应生成不溶于稀硝酸的白色沉淀AgCl,该性质可以用来检验溶液中是否含有氯化物。
③Mg(OH) 2和Mg(OH)Cl均为白色固体,不溶于水,能与盐酸、硝酸等反应。
【猜想与假设】
Ⅰ. ;Ⅱ.镁用量增多使生成的MgCl 2增多而析出晶体
Ⅲ.生成了Mg(OH) 2白色沉淀;Ⅳ.生成了Mg(OH)Cl白色沉淀
【实验探究二】过滤【实验探究一】D试管中的物质,将得到的白色不溶物分成三份,进行实验:
(1)取第一份白色不溶物于试管中,加入稀盐酸,现象为没有气泡产生。
结论:假设Ⅰ不成立。
(2)取第二份白色不溶物于试管中,加入适量蒸馏水,充分振荡后,不溶物没有减少。
结论:假设Ⅱ 。
(3)取第三份白色不溶物于试管中,加入适量稀硝酸,发现不溶物立即溶解,向所得无色溶液中加入几滴硝酸银溶液,出现白色沉淀。
结论:白色不溶物中一定含有 元素,由此推出假设Ⅳ 成立(填"一定不"、"一定"或"可能",下同),假设Ⅲ 成立。
【实验反思】
(1)甲同学对上述实验(3)的结论提出疑问,他认为实验(3)的设计不严密,要验证假设Ⅳ是否成立,在进行实验(3)之前应该 。
(2)在老师的帮助下,实验小组最终确定白色不溶物为Mg(OH)Cl,试写出镁与盐酸反应生成Mg(OH)Cl的化学反应方程式 ;为避免镁与盐酸反应生成Mg(OH)Cl,请你提出一条合理化建议 。