[题干]在一支试管中放入一小段镁条(已擦去氧化膜),再向试管中加入一定量的盐酸,镁条表面有 产生,反应的化学方程式是 .
[发现问题]为了再次观察上述反应现象,小林同学用较长的镁条重做上述实验,但发现了异常现象,试管中出现了白色沉淀.
[实验验证1]小林同学针对两次实验的不同,设计对比实验方案,探究出现异常现象的原因.
试管(盛有同体积同浓度的盐酸) |
① |
② |
③ |
④ |
镁条长度 |
1cm |
2cm |
3cm |
4cm |
相同的实验现象(省略题干现象) |
快速反应,试管发热,镁条全部消失 |
|||
沉淀量差异(恢复至20℃) |
无 |
少量 |
较多 |
很多 |
[得出结论]镁条与盐酸反应产生白色沉淀与 有关.
[追问]白色沉淀是什么物质?
[查阅资料]①20℃时,100g水中最多能溶解氯化镁54.8g.
②镁能与热水反应产生一种碱和氢气;
③氯化银既不溶于水也不溶于稀硝酸.
[做出猜想]猜想一:镁;猜想二:氯化镁;猜想三:氢氧化镁,猜想的依据是 (用化学方程式表示).
[实验验证2]将白色沉淀洗涤干净,分别取少量沉淀于A、B、C试管中,进行如表实验:
试管 |
操作 |
现象 |
结论 |
A |
加入足量盐酸 |
,白色沉淀 |
猜想一不正确,但这种白色沉淀能溶于盐酸 |
B |
加入足量水 |
白色沉淀 |
猜想二不正确 |
C |
加入适量稀硝酸 |
白色沉淀消失 |
原白色沉淀中含有的离子是: Mg 2+、 |
继续滴加几滴硝酸银溶液 |
出现大量白色沉淀 |
[拓展延伸]足量镁与盐酸反应过程中,溶液会经历从酸性到碱性并且碱性逐渐增强的过程,从而促使白色碱式氯化镁的生成.
“少一些烟尘,多一片蓝天,建设文明城市,人人有责”
(1)汽车尾气在装有催化剂的净化器中反应的微观过程可用下图表示:

①该反应中没有发生改变的粒子是 ;(填“分子”“原子”或离子”)
②写出上述反应的化学方程式: 。
(2)煤燃烧时产生的二氧化硫是形成酸雨的主要气体之一,可用 来测定雨水的酸碱度,请你提出一条防止酸雨发生的建议: 。
实验室固体氢氧化钠敞口放置在空气中容易变质而失效,现称取该久置于空气中的烧碱样品10.6g完全溶于蒸馏水中配成100g溶液,向其中滴加质量分数为3.7%的氢氧化钙溶液,产生沉淀与所加氢氧化钙溶液的质量关系如图所示。请通过计算回答:
(1)该烧碱样品变质的程度为 (填"部分变质"或"全部变质")。
(2)m= g。
(3)当沉淀刚好达到最大质量时,溶液中溶质质量分数为多少?(写出计算过程,计算结果精确到0.01%)

2017年6月11日,兰州国际马拉松赛如期举行。兴奋剂是国际体育界违禁药物的总称,甲基苯丙胺(C 10H 15N)是兴奋剂的一种,称之为"冰毒",该药小剂量时有短暂的兴奋抗疲劳作用。
(1)甲基苯丙胺中碳、氢、氮的质量比为 。
(2)14.9g甲基苯丙胺中氮元素的质量为 。
某校初三化学课在进行氢氧化钠化学性质教学时,同学们做了如下实验:将一定量的稀盐酸加入到盛有NaOH溶液的小烧杯中。
(1)请写出该反应的化学方程式: 。
【提出问题】实验过程中未观察到明显现象,对此同学们产生了疑问:反应后溶液中溶质是什么?
【假设猜想】针对以上疑问,第一小组同学提出如下猜想:
猜想一:只有NaCl 猜想二:有NaCl和HCl
猜想三:有NaCl和NaOH 猜想四:有NaCl、HCl和NaOH
(2)肖晓同学对以上猜想中有一种是不可能的。不可能的猜想是
【实验探究】为了验证其余猜想,各小组同学利用烧杯中的溶液,进行下列实验:
|
实验方案 |
实验操作 |
实验现象 |
实验结论 |
|
方案一 测烧杯中溶液的pH |
① |
试纸变色,与标准比色卡对比,pH<7 |
溶液中有HCl |
|
方案二 滴加CuSO 4溶液 |
取少量烧杯中的溶液于试管中,滴加几滴CuSO 4溶液 |
无明显现象 |
溶液中一定没有:② |
|
方案三 滴加Na 2CO 3溶液 |
取少量烧杯中的溶液于另一支试管中,滴加少量Na 2CO 3溶液 |
③ |
溶液中有HCl |
|
方案四 滴加AgNO 3溶液 |
再取少量烧杯中的溶液于另一支试管中,滴加少量AgNO 3溶液 |
产生白色沉淀 |
溶液中有HCl |
【得出结论】通过实验探究,全班同学一致确定猜想三是正确的。
【评价反思】老师对同学们能用多种方法进行实验探究,并且得出正确结论给予表扬,同时指出以上实验结论中有一个是错误的,请你指出错误的结论并说明原因: 。
早在春秋战国时期,我国就开始生成和使用铁器了。工业上炼铁的原理利用一氧化碳和氧化铁的反应。某校化学兴趣小组利用如图装置进行炼铁原理的实验探究(夹持装置省略)。请按要求填空:
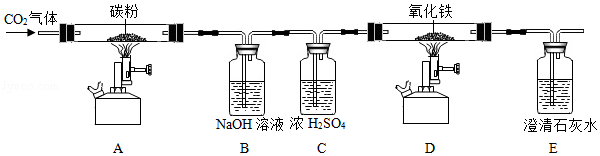
(1)写出装置A中反应的化学方程式: 。
(2)装置B的作用为 ,写出其中反应的化学方程式: ;
(3)当装置D硬质玻璃管中看到的现象为 、装置E中看到的现象为 时,说明装置D中反应发生了。
(4)同学们在讨论实验时,发现该装置存在一个不环保的缺陷,请你指出来: 。