今年年初,科学家利用显微镜针头手工“敲打”原子,首次成功合成能稳定存在4天之久的三角烯分子。三角烯(化学式为C22H14)将在量子计算、量子信息处理和自旋电子学等领域展现巨大应用潜力。请计算:
(1)C22H14中碳氢元素的质量比为 。
(2)C22H14中碳元素的质量分数为 (计算结果精确到0.01% )。
利用废弃的黄铜(含铜、锌)制取海绵铜(Cu),并得到硫酸锌溶液,主要流程如图(反应条件已略去):

已知:2Cu+2H2SO4+O2 2CuSO4+2H2O
(1)过程Ⅱ中加入过量锌粉的目的是 。
(2)过程Ⅲ中有气体产生,所选用的物质C是 (填一种酸)。
如图是实验室制取气体的部分装置,回答有关问题。

(1)指出图中标示的仪器名称:a 。
(2)实验室若选用B装置制备氧气,反应的化学方程式 。收集氧气可选择的装置 (填一个序号)。
(3)实验室制取二氧化碳时,常选用C装置收集气体,证明是否集满的方法是 。
向表面生锈的铁片中滴加稀硫酸,产生氢气的质量与所加稀硫酸的质量关系如图所示,请回答:
(1)从图中可以看出完全反应后产生氢气的质量为 g。
(2)求所加稀硫酸中溶质的质量分数。(写出计算过程,计算结果精确到0.1%)

某化学兴趣小组为验证酸的通性,做了以下5组实验,请分析并回答问题:
[演示实验]

[提出质疑]实验③没有明显现象,甲同学对该实验是否发生化学反应提出质疑,并设计了以下实验进行验证。
[实验探究]
|
实验方案 |
实验操作 |
实验现象 |
实验结论 |
|
一 |
测定氢氧化钠溶液的pH=a,滴加稀盐酸后测得溶液pH=b(忽略体积的变化) |
a b (填“>”、“<”或“=”) |
发生了反应 |
|
二 |
向实验③所得混合溶液中加入硝酸银溶液 |
有白色沉淀产生 |
发生了反应 |
[评价交流]乙同学认为甲同学的验证实验中方案二不可行,理由是 。
[拓展延伸]演示实验中有一组没有验证酸的通性,该组是 (填序号)。请你补充一个演示实验(不改变反应物的类别)完整验证酸的通性,该实验的化学方程式为 。
硫化氢(H2S)是一种密度比空气密度大的气体,实验室通常用固体硫化亚铁(FeS)和稀硫酸混合,常温下通过发生复分解反应制得硫化氢气体。试回答:
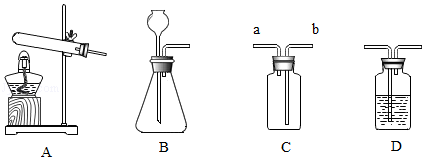
(1)实验室制取硫化氢气体的化学方程式为 。
(2)根据装置图回答下列问题。
①制得硫化氢气体的发生装置可以选用 (填序号)。该装置在实验室还可以用来制取氧气,写出用该装置制取氧气的化学方程式 。
②若用C装置收集硫化氢气体,进气口应为 (填“a”或“b”)。