化学活动课上同学们对金属的性质及合金的成份进行了探究,请你参与。
(1)取等质量的金属,分别加入足量稀硫酸,完成如表四组实验。
药品/序号 |
A |
B |
C |
D |
金属 |
铜粉 |
锌粉 |
锌粉 |
镁粉 |
稀硫酸 |
9.8%硫酸 |
19.6%硫酸 |
9.8%硫酸 |
9.8%硫酸 |
①写出实验中一个反应的化学方程式 。
②根据表中 实验(选填序号),即可判断Mg、Cu、Zn三种金属的活动性顺序。
(2)探究合金的成份,某合金可能由Mg、Cu、Zn、Al四种金属中的两种组成。
[提出问题]合金由哪两种金属组成?
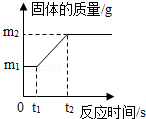
[实验探究]①取该合金m1g,在足量氧气中反应,生成固体质量为m2g,m1和m2的关系如图所示,则(m2﹣m1)g表示的意义是 。
②再向m2g的固体中加入稀硫酸,微热,固体全部溶解,得溶液M,继续进行如下实验,补充完成内容。
实验操作 |
实验现象 |
结论和化学方程式 |
向M中加入ag铁粉、搅拌 |
化学方程式: M中的溶质: |
|
过滤,把所得固体洗涤、干燥,称其质量也为ag,并向此固体中加入稀硫酸 |
无明显现象 |
[分析结论]③若m1=4,m2=7.2,结合上述实验分析,合金的成份是 。
(3)根据上述实验总结金属的化学性质 。
为建设环保节能型城市,襄阳市在许多小区和道路安装了太阳能路灯,制造太阳能路灯的单质硅(Si),可以用石英固体(SiO 2)与碳在高温条件下反应制得,同时生成一种可燃性气体,该反应的化学方程式为 .
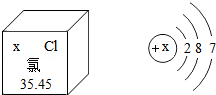
在元素周期表中,氯元素的信息如图所示,由图可知:x= ,在化学反应中氯原子容易 (填"失去"或"得到")电子而变成 (填化学符号).
学好化学,有助于我们科学地处理和解决生产、生活中的一些问题:
(1)青少年多食用豆类、虾皮等富含 元素的食物可以有效预防佝偻病;
(2)利用活性炭的 性可以有效地取出冰箱异味;
(3)将空气中含量最多的物质 (填化学式)充入食品包装袋可以延长食品保质期;
(4)炒菜时油锅着火,可用 的方法扑灭.
某金属冶炼厂在生产过程中产生了一定量的含铜废料。化学兴趣小组利用稀硫酸和铁粉分离回收铜,并获得硫酸亚铁晶体。其设计方案如图1所示。
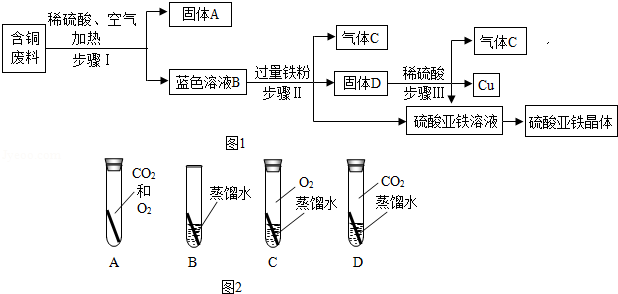
查阅资料得知:在通入空气并加热的条件下,铜可与稀硫酸反应转化为硫酸铜,反应的化学方程式:2Cu+2H 2SO 4+O 2 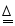 2CuSO 4+2H 2O。
2CuSO 4+2H 2O。
(1)步骤Ⅰ中分离得到固体A和蓝色溶液B的操作名称是 。
(2)蓝色溶液B中的溶质是 (填化学式)。
(3)写出步骤Ⅲ中发生反应的化学方程式 。
(4)硫酸亚铁可用作治疗 (选填"贫血症"或"佝偻病")的药物。
(5)铜制品在空气中会发生锈蚀[铜锈的主要成分是Cu 2(OH) 2CO 3].根据铜锈的主要成分中含有氢元素和碳元素,可以判断出铜锈需要空气中的 (填化学式).若要探究"铜生锈是否需要空气中的氧气?"如图2所示实验中,只需完成 (填字母)两个实验即可达到实验目的。
如图是初中化学常见气体的发生装置,根据要求回答下列问题。
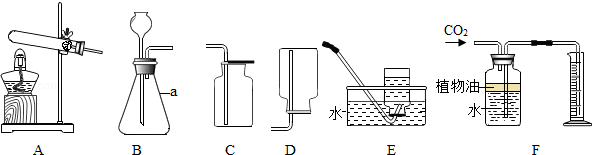
(1)仪器a的名称是 。
(2)实验室制取二氧化碳的化学方程式是 。用F来测量生成二氧化碳的体积,其中在水面上放一层植物油的目的是 。
(3)实验室用高锰酸钾制取氧气所选用的发生装置是 (填序号),该反应的基本反应类型为 。用E装置收集氧气时,观察到导管口的气泡 ,再把导管口伸入盛满水的集气瓶。