人类对材料的发现和使用经历了从石器、青铜器、铁器到铝的大规模使用等漫长的征程。请回答:
(1)我国最早使用的合金是 ;
(2)我国是最早采用湿法冶铜的国家。文献记载“胆铜法”:用铁与“胆水”(含CuSO4)反应获得铜。铁与硫酸铜溶液反应的化学方程式为 ;
(3)下列金属矿物中,可以用来炼铁的是 (填正确选项前的字母);
A.赤铜矿(Cu2O) B.赤铁矿(Fe2O3) C.软锰矿(MnO2)
(4)19世纪初,铝的发现得益于电解技术的应用。如图为用铝土矿炼制铝的生产流程。

现有含Al2O351%的铝土矿200t,经上述反应后可制得铝 t (假设上述各步反应中,铝元素一共损失10%.计算结果精确到小数点后一位)。
如图是画家用碳墨绘画的我国明朝诗于谦《石灰吟》的国画,诗中写道:“千锤万凿出深山,烈火焚烧若等闲,粉身碎骨浑不怕,要留清白在人间”。试回答:
(1)该字画能够保存多年而不变色,原因是。
(2)诗句中“千锤万凿出深山”所体现物质的变化:是变化;“烈火焚烧若等闲”所体现的化学反应是石灰石受热分解,该反应是反应(填“吸热”或“放热”)
(3)“要留清白在人间”指的是石灰水暴露在空气中所发生的化学反应,该化学方程式为。
联合国第63届大会决定将2011年作为国际化学年,其主题是“化学-人类的生活,人类的未来”。请回答下列化学与人类生活相关的问题。
(1)自热米饭是一种快餐食品。请根据下图及表中信息,回答下列问题:
| 自热米饭的营养成分 |
|
| 营养素 |
每份含量 |
| 蛋白质 |
29.6g |
| 油脂 |
23.5g |
| 糖类 |
104.7g |
| 钠 |
814mg |
| 钙 |
130mg |
①自热米饭的营养素中,主要负责为人体提供能量的是,构成细胞的基础物质是。
②图中菜肴包的包装材料是符合卫生标准的铝箔。铝可以压制成铝箔,说明铝具有良好的。
③该自热米饭是利用发热包中的生石灰与水反应放出热量来进行加热,生石灰与水反应的化学方程式为。
④大米中含有丰富的淀粉,人体食用大米后,大米中的淀粉在淀粉酶和水的作用下,先转化为,然后在人体内缓慢氧化转变成和。
(2)良好的家居环境带来美好的生活。房屋装修后,可在室内放一些活性炭来吸收装修材料释放出的甲醛、苯等有毒气体,这是利用活性炭的性。
(3)汽车是现代生活中常见的一种交通工具。
①喷漆可以延缓汽车钢铁外壳的锈蚀,其防锈原理是隔绝和。
②为了确保威海市区的空气质量,今年威海市将新购置200辆环保型公共汽车,淘汰部分污染大的燃油型公共汽车,这种环保型汽车所用的燃料是压缩天然气。写出天然气(主要成分是甲烷)完全燃烧的化学方程式。
从楚王陵中出土的铁器中发现了迄今世界上最早的炒钢技术,说明中国早在公元前2世纪就掌握了炒钢技术。
炒钢是一种冶炼技术,冶炼时先将生铁加热到液态或半液态,然后靠鼓风或加进精矿粉,降低生铁的含碳量,使其成钢。由于在冶炼中要不断搅拌,好象炒菜一样,因而得名。
(1)生铁的含碳量比钢的含碳量(填“高”或“低”),炼得的钢是(填“纯净物”或“混合物”)。
(2)将生铁加热到液态或半液态并不断搅拌的原因是什么?
.
(3)向液态生铁中鼓风(通入空气)发生反应的化学方程式;向液态生铁中加进精矿粉(以赤铁矿为例)发生反应的化学方程式(友情提示:Fe2O3与生铁中的碳高温下反应生成铁和二氧化碳)为。
将一根锃亮的铁丝放入蓝色的硫酸铜溶液中,过一会儿,发现铁丝表面出现了红色物质。
(1)写出发生反应的化学方程式:。
(2)由此判断,金属的活动性:Fe Cu(用“>”、“=”、“<”填空)。
(3)在化学反应中,元素化合价升高的反应物是还原剂,元素化合价降低的反应物是氧化剂。试判断上述反应中,氧化剂是。
金属材料在国防建设中起着重要的作用,图1为歼-15飞机在辽宁舰上起飞.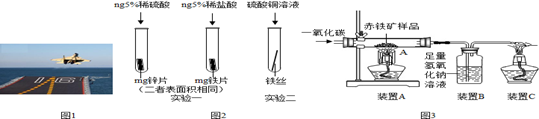
(1)铝合金用于制造飞机的外壳,铝合金材质的主要优点是_______
(2)改装前的辽宁舰舰身锈迹斑斑,钢铁的锈蚀主要是铁与空气中的_____________共同作用的结果.工业生产中常用稀盐酸除去铁制品表面的铁锈,该反应的化学方程式为___________________
(3)为了避免轮船的钢质外壳被腐蚀,通常在轮船外壳上镶嵌比铁活动性强金属.小明为探究锌、铁、铜三种金属的活动性顺序,设计了如图2的两个实验:
①实验一中,小明以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不够合理,理由是____________________②实验二中,若出现___________________现象,可证明铁的活动性强于铜,该反应的化学方程式为____________________
(4)辽宁舰的建造耗费了大量的钢材.某兴趣小组在实验室用图3所示装置模拟炼铁的化学原理,并测定赤铁矿中氧化铁的质量分数(装置气密性良好,反应完全且赤铁矿中的杂质不参加反应,称重赤铁矿样品的质量为wg).
①装置A中生成铁的化学方程式为__________,装置B中发生反应的化学方程式为____________.
②要测定该赤铁矿样品中氧化铁的质量分数,需要测量的数据是____________或___________.