如图装置可以做CO还原Fe2O3的实验并检验该反应的气体生成物。已知由一氧化碳发生装置得到的CO中混有杂质CO2和H2O。

(1)写出B装置玻璃管内反应的化学方程式。
(2)从环保角度考虑,请写出一种尾气处理方法。
(3)若没有A装置,则该实验不能达到检验气体生成物的目的,请说明原因。
多角度认识硫化氢气体
硫化氢( H2S)在化学研究和化工生产中有着广泛应用。道尔顿等科学家对它进行过深入研究。请认真阅读下列资料,并结合你学过的知识,回答问题(1)~(4):
资料一:硫化氢是一种无色、有臭鸡蛋气味的剧毒气体,密度比空气大,能溶于水,其水溶液称为氢硫酸,具有酸的通性。实验室中用硫化亚铁( FeS)与稀硫酸反应制取硫化氢气体。
资料二:道尔顿在其著作《新系统》中时硫化氢的研究有以下记载(大意);
A.硫化氢在密闭容器中受热,生成硫和与硫化氢等体积的氢气;
B.常温常压下,硫化氢与氧气按2:1的体积比混合,点燃,生成硫和水,无气体剩余;
C.常温常压下,硫化氢与氧气按2:3的体积比混合,点燃,恰好完全反应生成二氧化硫气体和水。
资料三:在相同温度和压强下,气体的体积之比等于分子个数之比。
(1)从宏观上看,硫化氢由 组成:从微观上看,硫化氢是由 构成。
(2)氢硫酸有酸性的本质原因是 ,资料一和二中描述的硫化氢的化学性质还有 、 、 。
(3)资料二的实验B中发生反应的化学方程式 ,C实验中反应前后气体的体积比为 ,B、C实验中硫化氢均发生 反应。
(4)实验室用如图所示的装置制取并探究硫化氢气体的性质。
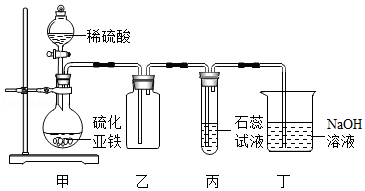
①甲装置中发生反应的化学方程式为 ;
②实验中收集气体的方法是 ;
③实验中,丙装置观察到的实验现象是 ;
④丁装置的作用是 ,反应的化学方程式为 ,反应的实质是 。
用化学方法改造物质﹣﹣“二氧化碳变汽油”二氧化碳是化石燃料燃烧的产物,汽油(主要成分为含有5个﹣11个碳原子的碳氢化合物)是全球用量最大的液体燃料。如果有人告诉你“二氧化碳能变成汽油”,你相信吗?
近日,中科院大连化学物理研究所研制出一种新型多功能复合催化剂,通过如图示意的I、II、III三个环节,将二氧化碳成功转化为汽油。(图中a、b是两种起始反应物的分子结构模型,c、d是最终制得的汽油中所含物质的分子结构模型)
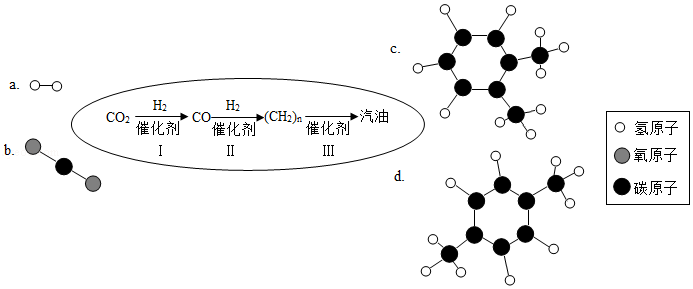
请回答下列问题:
(1)要实现物质间的转化,往往需要有高效的催化剂。下列有关催化剂的叙述正确的是 (填字母编号)。
A.催化剂可以改变化学反应速率
B.化学反应前后催化剂的质量不变
C.化学反应前后催化剂的化学性质发生改变
(2)在一定温度、一定压强和催化剂存在的条件下,环节Ⅰ除生成CO外,还生成了一种化合物,则反应的化学方程式为 。该反应中,二氧化碳中的部分氧元素被氢气夺去,二氧化碳发生了 反应。
(3)从物质类别的角度看,环节Ⅱ实现了 的转化。
(4)认真观察c和d两种物质的分子结构模型,试写出c物质的分子式 ,c和d的分子式是否相同? ,二者是否为相同物质? ,d物质中碳元素和氢元素的质量比为 。
(5)“二氧化碳变汽油”的研究成果,使我国成为此领域的世界领跑者。你认为该成果的现实意义是 , (答出两条即可)。
现有一家庭使用纯碱样品,其中含杂质氯化钠(不含其它杂质),为了测定样品中杂质氯化钠的质量分数,李明同学进行了三次实验。实验数据如表。
|
编号 |
第1次 |
第2次 |
第3次 |
|
所取固体样品的质量/g |
15 |
12 |
12 |
|
加入氯化钙溶液的质量/g |
100 |
100 |
150 |
|
反应后生成沉淀的质量/g |
10 |
10 |
10 |
完成下列计算(计算结果精确到0.1%):
(1)样品中氯化钠的质量分数;
(2)加入氯化钙溶液的溶质质量分数;
(3)恰好完全反应时,反应后所得溶液中氯化钠的质量分数。
“舌尖上的中国”在央视上的热播让厨房再次成为人们施展厨艺的物态。大多数厨师有个工作经验:炒菜时,又加料酒又加醋,可使菜变得香美可口,原因是醋中的乙酸与料酒中的乙醇生成乙酸乙酯。如表中是几种常见的酯,请完成下列问题:
|
酯的名称 |
甲酸甲酯 |
甲酸乙酯 |
乙酸甲酯 |
乙酸乙酯 |
|
化学式 |
C2H4O2 |
C3H6O2 |
C3H6O2 |
X |
(1)甲酸甲酯(C2H4O2)中碳元素、氢元素、氧元素的质量比为 ;
(2)甲酸乙酯(C3H6O2)中碳元素的质量分数为 (计算结果精确到0.1%);
(3)比较归纳是学习化学的重要方法,据表推测X的化学式为 。
碳酸氢钠是小苏打的主要成分,在生产和生活中有许多重要的用途。化学课上,同学们为了解碳酸氢钠的性质,将一定质量的碳酸氢钠和稀硫酸混合,充分反应后,有气体逸出,写出该反应的化学方程式 ,同学们对反应后溶液中溶质的成分进行了探究:认为除一定含有硫酸钠外可能还含有其他成分,因此进行了猜想并做了如下实验:
[实验用品]pH试纸、锌片、氧化铜粉末、稀硫酸、氢氧化钠溶液、氯化钡溶液。
[猜想与假设]反应后溶液总溶质的可能组成成分。
猜想一:硫酸钠
猜想二:硫酸钠、碳酸氢钠
猜想三:硫酸钠、硫酸
[实验探究]同学们取反应后的溶液用不同方案进行如下实验,请根据结论完成如表实验现象中的空格。
|
实验方案 |
A |
B |
C |
D |
|
实验操作 |
|
|
|
|
|
实验现象 |
|
产生白色沉淀 |
试纸变色,对照标准比色卡,pH 7 |
|
|
实验结论 |
猜想二不正确 |
猜想三正确 |
猜想三正确 |
猜想三正确 |
[得出结论]猜想三正确。
[评价反思]
(1)老师对同学们能用多种方案进行探究,并且得出正确的实验结论给予了肯定,同时指出探究中存在一处明显错误是: 。
(2)有同学对实验方案B的结论提出了质疑,认为仅凭此现象不能得出猜想三正确,请说明理由 。
[总结提高]依据所给实验用品,设计不同的方案确认猜想三是正确的,请你写出你的实验方案 。