某化学学习小组的同学对一瓶久置的氢氧化钠的化学成分产生了兴趣,他们根据自己已学的知识进行如下探究,请你共同参与并填空:
[猜想假设]
猜想一:只有氢氧化钠
猜想二:是氢氧化钠和碳酸钠的混合物
猜想三: .
[查阅资料]
(1)BaCl2溶液显中性
(2)Na2CO3溶液与BaCl2溶液能反应产生白色沉淀
[实验探究]
实验步骤 |
实验现象 |
实验结论 |
(1)用小试管取少量固体样品加水完全溶解,再滴加过量BaCl2溶液 |
产生白色沉淀 |
猜想 不正确 |
(2)取(1)中的少量上层清液于试管中,滴加酚酞溶液 |
|
猜想二正确、猜想三不正确 |
[实验结论]
该氢氧化钠样品已部分变质,其化学成分是NaOH与Na2CO3的混合物,引起NaOH变质的化学方程式为 .
[反思交流]
(1)实验室应 保存氢氧化钠;
(2)某同学认为用CaCl2溶液代替BaCl2溶液也可以得到同样的结论,另一位同学认为不可以,理由是:CaCl2溶液和NaOH溶液相混合也会出现 .因为Ca(OH)2是 .
[实验回顾]18世纪末,英国科学家普利斯特里和卡文迪许把“易燃空气”与空气或氧气混合后盛在干燥、洁净的玻璃瓶中,当用电火花点火时,发出震耳的爆鸣声,且玻璃瓶内壁上出现了液滴.一年之后,拉瓦锡重复了他们的实验,并做了一个相反的实验:让水蒸气通过一根烧红的枪管,得到了“易燃空气”,这里的“易燃空气”是指 (填化学式),通过上述实验得到的结论是 。

[实验重现]某化学兴趣小组的同学在创新的基础上,在实验室中重做上述两个实验,做法如下:
实验1:水的通电分解实验
如图1所示,打开活塞b,用燃着的木条在玻璃管尖嘴口检验反应产生的气体,看到的现象是 ,证明该气体为 .
实验2:“易燃空气”与氧气混合后的点燃实验
实验室现有过氧化氢溶液、氯酸钾、二氧化锰、稀硫酸、锌粒,如图2是实验室常用部分仪器:
(1)指出图中仪器的名称:D .
(2)利用上述仪器和药品制取少量氧气,其简易发生装置应选择的仪器有 (填序号),反应的化学方程式为 .
(3)利用上述仪器和药品制取较多量的“易燃空气”,且可以随时补充液体,你选择的仪器有 (填序号),药品是 .该兴趣小组的同学把“易燃空气”与氧气按一定比例混合后盛在干燥、洁净的玻璃瓶中,用电火花点火,顺利完成上述实验.
(4)该兴趣小组的同学决定利用制得的“易燃空气”和空气继续进行探究,他们取7支试管,依次盛水90%(体积分数),80%…再用排水集气法收集“易燃空气”,而后分别把试管口移近酒精灯的火焰,实验结果如表所示:
|
序号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
“易燃空气”体积分数(%) |
90 |
80 |
70 |
50 |
20 |
10 |
5 |
|
空气体积分数(%) |
10 |
20 |
30 |
50 |
80 |
90 |
95 |
|
点燃现象 |
安静燃烧 |
安静燃烧 |
弱的爆鸣声 |
强的爆鸣声 |
强的爆鸣声 |
弱的爆鸣声 |
不燃烧 不爆鸣 |
分析表中信息,完成下列问题:
①在混合气体爆炸范围内,“易燃空气”的体积分数约为 .
②你对燃烧或燃烧条件的新认识是 .
化学实验过程中要规范操作,注意安全.下列有关做法错误的是 .
A、稀硫酸沾到皮肤或衣物上,如果浓度不大,可暂不处理,或用水冲洗一下即可
B、实验室中的药品经确认无毒无害的,可以品尝一下以感受其味道
C、给烧杯中的液体加热时,烧杯下面必须垫石棉网
D、称量药品时,为避免药品腐蚀托盘,应将药品放在纸上称量
E、对于溶解时没有明显热量变化的液体,可用量筒完成溶液的配制
F、实验完毕后,应及时洗涤所用的器皿,仪器、药品归类整理,放在规定的位置.
硫酸亚铁在工农业生产中有重要用途,也有较高的医用价值。工业上用废铁屑和含硫酸的废液来制取硫酸亚铁,变废为宝。现用5.6t铁屑与100t废液恰好完全反应(已知铁屑只和废液中的硫酸反应),请你计算:
(1)可生成硫酸亚铁的质量;
(2)所用废液中硫酸的溶质质量分数。
化学兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验(如图1),同学们观察到镁条在空气中剧烈燃烧,发出耀眼的强光,产生的大量白烟弥漫到空气中,最后在石棉网上得到一些白色固体。
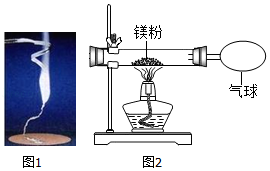
(1)请写出镁条燃烧的化学方程式 ;
(2)同学们通过称量发现:在石棉网上收集到产物的质量小于镁条的质量,有人认为这个反应不遵循质量守恒定律。你认为出现这样实验结果的原因可能是: ;
(3)小红按图2装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
[提出问题]黄色固体是什么?
[查阅资料]①氧化镁为白色固体;②镁能与氮气剧烈反应产生黄色的氮化镁(Mg3N2)固体;③氮化镁可与水反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
[做出猜想]黄色固体是Mg3N2
[实验探究]请设计实验,验证猜想
|
实验操作 |
实验现象及结论 |
|
|
|
[反思与交流]①氮化镁中氮元素的化合价是 ;
②空气中N2的含量远大于O2的含量,可是镁条在空气中燃烧产物MgO却远多于Mg3N2,合理的解释是: 。
③同学们又联想到氢气在氯气中能够燃烧,于是对燃烧条件又有了新的认识: 。
正确选择实验仪器是实验成功的重要保证。下面是实验室中常见的仪器,请按要求填空。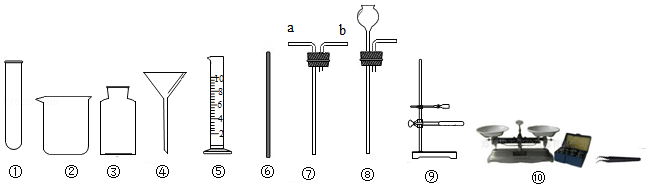
(1)配制一定溶质质量分数的氯化钠溶液,需要用到的仪器有 (填序号),还缺少的两种仪器是 (填名称);过滤粗盐水所用到的仪器有 (填序号)。
(2)实验室用锌粒和稀硫酸制取氢气,可选用上述仪器中的 (填序号)组合成发生装置。
(3)利用仪器③与⑦可组合成一个贮气装置,收集氢气(氢气难溶于水、密度小于空气)时,气体应从仪器⑦的 (填“a”或“b”)端通入,该装置还有其他的用途,请你任举一例: 。