实验室制取气体常用的发生装置如图所示,回答下列问题。
(1)小刚选择A装置作为制取氧气的发生装置,反应的化学方程式为 ,小明选择B装置也能作为制取氧气的发生装置,其理由是 。与A装置相比,B装置具有的优点是 。
(2)某实验小组的同学们在进行“二氧化碳的实验室制取和性质”的实验活动时,选取上述装置制取二氧化碳气体后,产生了许多废液。于是他们在课外兴趣小组活动时对废液的成分进行了如下探究:
[提出问题]废液的主要成分是什么?
[猜想与假设]小红的猜想:废液中只有CaCl2;小丽的猜想:废液中还有HCl。
[查阅资料]CaCl2溶液呈中性。
[设计与实验]①小红做了一组对比实验:取等质量的废液和CaCl2溶液分别于两支试管中,各滴加2滴酚酞溶液后,发现溶液都不变色,认为自己的猜想是正确的。大家经过讨论,认为小红的猜想不正确,理由是 。
②针对小丽的猜想,同学们进行了如下实验探究:
实验方案 |
一 |
二 |
三 |
实验操作 |
|
|
|
预期的现象 |
与标准比色卡对比pH<7 |
|
白色沉淀 |
实验结论 |
废液中含有HCl |
废液中含有HCl |
废液中含有HCl,反应的化学方程式为 。 |
③小牛对上述探究活动思考后,认为利用酸的化学性质还可以设计不同方案探究小丽的猜想:
操作步骤 |
预期的现象 |
实验结论 |
取适量废液于试管中,加入 。 |
|
废液中含有HCl |
[解释与结论]同学们根据以上实验,讨论得出废液的主要成分是CaCl2和HCl。
[评价与反思]实验结束后,同学们对探究活动进行了如下反思:
①小强认为方案一中存在操作错误,错误的操作是 。
②小敏认为方案三不足以证明废液中含有HCl,理由是 。
③大家一致认为实验后的废液不能直接排放,理由是 (写一点)。要想从废液中得到CaCl2固体,可采用的方法是 。

碳酸锶(SrCO3)可用于制造红色火焰、荧光玻璃等。小赵同学为测定某SrCO3和NaCl固体混合物中SrCO3的质量分数,在三个烧杯中进行相关实验,实验所用稀盐酸的溶质的质量分数相同。所得数据如表所示:
|
烧杯编号 |
① |
② |
③ |
|
稀盐酸质量/g |
100 |
200 |
300 |
|
固体混合物质量/g |
100 |
100 |
100 |
|
反应后烧杯中物质的质量/g |
195.6 |
291.2 |
391.2 |
试求:
(1)烧杯②中产生CO2的质量为 g。
(2)原固体混合物中SrCO3的质量分数(计算结果精确到0.1%)。(提示:SrCO3+2HCl=SrCl2+CO2↑+H2O)
小晨同学从课外读物中得知:在加热条件下,钠与CO2反应的产物可能有C、CO、Na2CO3、Na2O.于是设计实验对产物成分进行探究。
[查阅资料]①BaCl2溶液呈中性
②4Na+O2=2Na2O
③Na2O+H2O=2NaOH
④2Na+2H2O=2NaOH+H2↑
⑤CO通入PdCl2溶液中有黑色沉淀生成
[提出问题]在加热条件下,钠与CO2反应的产物有哪些?
[猜想假设]猜想一:产物中一定有C
猜想二:产物中一定有CO
猜想三:产物中一定有Na2CO3
猜想四:产物中一定有Na2O
[实验验证]用如图所示装置(夹持装置已略去)进行实验探究。
装置A中发生反应的化学方程式为 ;装置C的作用是 。
|
序号 |
实验操作 |
实验现象 |
实验结论 |
|
(1) |
待钠完全反应后,将装置D中的固体置于烧杯中,加蒸馏水溶解 |
有黑色不溶物 |
猜想 正确 |
|
(2) |
将实验(1)所得混合物过滤,取滤液加入过量BaCl2溶液 |
|
猜想三正确 |
|
(3) |
\ |
|
猜想二正确 |
[反思与评价]小晨同学向实验(2)所得溶液中滴入几滴酚酞溶液,溶液呈红色。于是得出结论:在加热条件下,钠与CO2反应一定产生Na2O.该结论是否严谨? (填“是”或“否”),理由是 。
根据下列装置图回答问题:
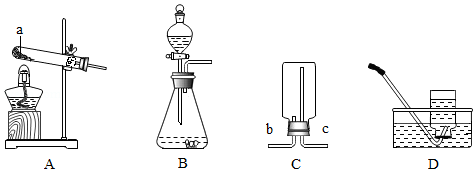
(1)仪器a的名称是 。
(2)实验室用高锰酸钾制取氧气,选择的发生装置是 (填标号),反应的化学方程式为 。
(3)实验室还可用过氧化氢溶液和二氧化锰制取氧气,反应的化学方程式为 。
(4)某气体能与氧气反应,不溶于水且不与水反应,选择的收集装置是 (填标号)。
(5)用装置C收集NH3,该气体应从 (填标号)端通入集气瓶。
请回答并完成下列计算。
(1)实验室要配制50g溶质质量分数为8%的氢氧化钠溶液,需称取 g氢氧化钠固体。
(2)向上述配制好的溶液中加入50g稀硫酸,恰好完全反应,求反应后所得溶液中溶质的质量分数(反应的化学方程式:2NaOH+H2SO4=Na2SO4+2H2O)
某白色固体可能由BaCl2、NaOH、Na2CO3、Na2SO4中的一种或几种物质组成。
某兴趣小组的同学为确定该白色固体的成分,进行了如下的实验探究,请你参与并回答
相关问题初步探究:小金同学设计的实验过程及现象如图所示
[查阅资料]BaCl2溶液显中性。

[初步结论]
(1)原白色固体中一定有的物质是 ,一定没有的物质是 。
(2)M溶液中的溶质一定有 ,一定没有氯化钡。
[交流讨论]小英同学认为:无色溶液M变红色,说明溶液M中含有碱性物质,但不能由此推导出原固体物质中是否含有氢氧化钠。若要进一步确定,需对溶液M继续进行探究。为此同学们进行了如下的探究:
Ⅱ.继续探究
[提出问题]无色溶液M中有氢氧化钠吗?
[猜想与假设]猜想一:有NaOH
猜想二:没有NaOH
[探究与结论]
|
实验步骤 |
实验现象 |
实验结论 |
|
A.取无色溶液M于试管中,加入过量的氯化钡溶液,振荡,静置 |
|
证明溶液M中有碳酸钠并被除尽 |
|
B.取实验A所得上层清液于试管中,加入 |
|
猜想一正确 |
在老师的指导下,同学们通过交流、讨论、实验,圆满地完成了这次探究活动。