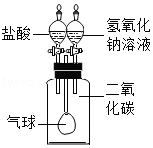
氢氧化钠溶液和二氧化碳反应没有明显现象,为验证CO 2与NaOH能够发生反应,某同学用右图组装实验装置,并进行实验。
(1)有时药品滴加顺序会影响实验现象。如果观察到的现象是"气球先膨胀,后变瘪",则加入试剂的顺序应该是 (填序号)
A.先加入盐酸,再加入氢氧化钠溶液 B.先加入氢氧化钠溶液,再加入盐酸
(2)请解释气球"先膨胀"的原因: 。
(3)写出气球"后变瘪"的化学方程式 。
某实验小组用KClO3和MnO2制取氧气,然后从制取后的残留固体中回收MnO2并用于实验室制取氯气(Cl2 )。部分实验装置如图所示。回答下列问题:

(1)写出装置Ⅰ中制取O2 的化学反应方程式: 。
(2)将制取氧气后的残留固体冷却、转移、 (填操作名称)、过滤、洗涤和干燥,即回收到MnO2.过滤装置Ⅱ中,仪器M的名称是 。
(3)将回收到的MnO2用于实验室制取Cl2.反应原理为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,实验装置为Ⅲ和Ⅳ,实验时,将a口连接 (填“b”或“c”)口收集Cl2,收集到的Cl2中的杂质有 (填化学式)。
MnCl2+Cl2↑+2H2O,实验装置为Ⅲ和Ⅳ,实验时,将a口连接 (填“b”或“c”)口收集Cl2,收集到的Cl2中的杂质有 (填化学式)。
(4)洁厕灵(主要成分为盐酸)与“84”消毒液(主要成分为NaClO)混合也会反应生成Cl2:2HCl+NaClO═R+Cl2↑+H2O,生成物R的化学式为 。
洁厕灵是常用的陶瓷清洗液,某同学对某品牌洁厕灵的有效成分含量进行探究。向一锥形瓶中加入100g该品牌的洁厕灵,再加入足量的溶质质量分数为8%的NaHCO3溶液120g,反应结束后溶液的总质量是215.6g。试计算下列问题:
[知识卡片]洁厕灵有效成分是HCl,洁厕灵中其它成分均不跟NaHCO3反应。
(1)产生的二氧化碳质量为 克。
(2)该品牌洁厕灵中HCl的质量分数是多少?(写出计算过程。)
阅读短文后回答下列问题。
燃料电池(Fuelcell),是一种使用燃料进行化学反应产生电能的装置,最早于1839年由英国的Grove发明。燃料的选择性非常多,包括纯氢气(H2)、甲醇(CH3OH)、乙醇(CH3CH2OH)、天然气,甚至于现在运用最广泛的汽油,都可以作为燃料电池的燃料。这是目前其他所有动力来源无法做到的。而以燃料电池做为汽车的动力,已被公认是二十一世纪必然的趋势。2017年,我国共有8个品牌的10款车型燃料电池汽车在产,总产量为1272辆,2018年国产燃料电池汽车已经超过3000辆。
燃料电池是以特殊催化剂作电极使燃料与氧气发生反应,生成二氧化碳和水。因其不需推动涡轮等发电器具,也不需将水加热至水蒸气再经散热变回水,所以能量转换效率高达70%左右,足足比一般发电方法高出了约40%;优点还不只如此,其二氧化碳排放量比一般方法低许多,且水又是无害的生成物,所以燃料电池是一种高效、低污染装置。
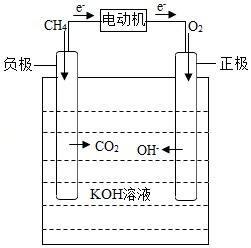
燃料电池主要由正极、负极、电解质溶液和外部电路4部分组成,其正极和负极分别通入燃料气和氧气(空气),负极上燃料气放出电子,外电路传导电子到正极并与氧气结合生成离子,在电场作用下,离子通过电解质转移到负极上再与燃料气进行反应,最后形成回路产生电能。与此同时,因为燃料自身的反应及电池存在的内阻,燃料电池也要排出一定的热量,以保持电池恒定的工作温度。如图是甲烷燃料电池的工作原理示意图。
(1)燃料电池是将 能转化为电能的装置。
(2)下列说法错误的是
A.化学反应放出的能量可以是光能、热能、电能等
B.燃料电池可以广泛用于新能源汽车
C.氢燃料电池汽车所需要的H2可电解水生成
D.燃料电池都要排放CO2气体
(3)写出甲醇完全燃烧的化学方程式 。
(4)甲烷燃料电池释放能量的总反应化学方程式是 。
某化学兴趣小组用实验室常用药品(或溶液)对“NaOH溶液与稀盐酸是否恰好完全反应”进行探究。
[知识卡片]:氯化钠溶液显中性,氯化铜易溶于水。
[实验探究]:
(1)方案Ⅰ:某同学先向试管中加入约2mLNaOH溶液,再滴入几滴酚酞溶液,溶液变红。然后慢慢滴入稀盐酸,边滴边振荡,直至溶液恰好变为无色。
①实验结论 。
②从微观的角度分析,该反应的实质是 。
③在滴入稀盐酸的过程中,若观察到有少量气泡出现。请分析产生气泡的可能原因 (用化学方程式表示)。
(2)方案Ⅱ:
|
实验步骤 |
实验现象 |
结论 |
|
取2mLNaOH溶液于试管中,滴入一定量的稀盐酸,振荡后加入镁条 |
若 |
稀盐酸过量 |
|
若没有明显现象 |
NaOH溶液与稀盐酸恰好完全反应 |
[实验反思]:
(3)另有同学提出方案Ⅱ不能证明NaOH溶液与稀盐酸恰好完全反应,其原因是 。
(4)除以上方案外,下列哪些物质单独使用,也能证明“NaOH 溶液与稀盐酸是否恰好完全反应” (填序号)。
A.铜片 B.pH试纸 C.氧化铜 D.紫色石蕊试液
向部分变质的NaOH溶液中逐滴滴加稀盐酸,产生气体质量与所加稀盐酸质量关系如图所示:
(1)完全反应后,产生气体的质量是 g。
(2)当滴加稀盐酸至图中A点时,溶液中含有的溶质是 。
(3)计算所加稀盐酸中溶质的质量分数。(写出规范的计算过程)。
