实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如图),化学小组的同学经过寻问老师后只知道是NaCl、NaOH、Na2CO3、NaHCO3中的一种溶液,为确认原瓶中是何种溶质并判断其是否变质,化学小组的同学进行了如下的探究活动:
[进行猜想]
猜想I:原溶液的溶质是NaCl;
猜想II:原溶液的溶质是NaOH;
猜想III:原溶液的溶质是Na2CO3;
猜想IV:原溶液的溶质是NaHCO3。
[查阅资料]
常温下,有关物质的相关信息如下表:
物质 |
NaCl |
NaOH |
Na2CO3 |
NaHCO3 |
常温下的溶解度/g |
36 |
109 |
21.5 |
9.6 |
常温下稀溶液的pH |
7 |
13 |
11 |
9 |
从物质的相关信息可知,原溶液的溶质一定不是NaHCO3,因为 。
[进行实验]
(1)取少量样品,测得溶液的pH大于7,则原溶液的溶质肯定不是 。
(2)同学们另取样品又进行了如下实验,实验过程如下:

①生成白色沉淀A的化学方程式 。
②通过实验可以判断样品无色溶液中含有的溶质有
[获得结论]
实验完成后,最终得到的结论:原瓶中的溶质是 ,且已变质。

如图是实验室制取并验证某种气体化学性质的有关装置,据此回答下列问题:
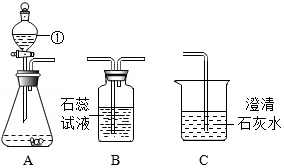
(1)仪器①的名称是 ;
(2)组装好装置A 后,必须首先 。
(3)若A 与C连接,C中澄清的石灰水变浑浊,则实验室制取该气体的化学方程式是 ,用 法收集该气体。
(4)若A 与B连接,则B中紫色石蕊试液变 色。
为减少或消除燃煤烟气中二氧化硫的含量,可向原煤中加入石灰石、碱石灰(NaOH和CaO的混合物)等脱硫剂。利用数字化实验测定燃煤烟气中二氧化硫的含量,得到如图所示的二氧化硫含量随时间的变化曲线。 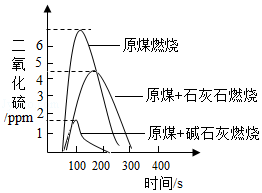
(1)结合图形和所学知识判断,下列说法正确的是 (填序号)
a.碱石灰的脱硫效率比石灰石的要高
b.将时间由300s变成400s,能提高碱石灰的脱硫效率
c.将原煤和脱硫剂粉碎、混合均匀,能提高脱硫效率
d.燃煤烟气中二氧化硫的浓度对脱硫速率没有影响
(2)某火力发电厂产生的燃煤烟气中SO 2的平均含量为0.032g/L,若用碱石灰处理8×10 4L燃煤烟气,理论上需要碱石灰的质量至少为多少克?(写出计算过程)
已知:①氢氧化钠与二氧化硫反应转化为Na 2SO 3,氧化钙与二氧化硫反应转化为CaSO 3。
②假设二氧化硫全部被吸收。
向Na2CO3溶液中加入一定量MgCl2溶液,出现白色沉淀。某同学经过过滤、洗涤、低温烘干得白色固体,并进行如下探究:
【猜测】白色固体可能是:①MgCO3;②Mg(OH)2;③ 。
【资料】MgCO3、Mg(OH)2加热易分解,生成对应的两种氧化物。
【实验1】
(1)取适量白色固体,充分加热,将产生的气体通过装有无水硫酸铜的U形管,观察到现象为 ,则猜测①不成立。
(2)另取适量白色固体于试管中,加入 ,产生大量气泡,则猜测②不成立。有同学查阅资料得知上述固体应为碱式碳酸镁[aMgCO3•bMg(OH)2•4H2O],其不溶于水,加热易分解,工业上常用作阻燃剂。
【实验2】
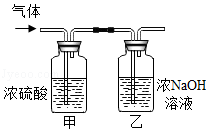
(3)为进一步确定白色固体的组成,该同学取适量白色固体,充分加热至质量不再改变,并使产生的气体全部缓缓通过如图所示装置,测定生成气体的质量。
实验中浓硫酸的作用 ,浓NaOH溶液的作用 。
实验数据:
①加热后剩余固体质量2.0g:②浓硫酸增重0.9g:③浓NaOH溶液增重1.76g。则a:b= 。
【拓展】
(4)如果将甲、乙装置顺序颠倒,则a:b的值会 (填“变大”、“变小”或“不确定”)。
(5)写出该碱式碳酸镁受热分解的化学方程式 。
(6)工业上用碱式碳酸镁作阻燃剂,其可能的原因有:①分解时吸热,降低了燃烧物的温度;②生成的二氧化碳、水等非可燃性气体,稀释了可燃物周围的氧气浓度;③ 。
某实验小组利用如图装置进行“燃烧条件的实验探究”。回答下列问题:

(1)实验前,检验装置A气密性的操作为 ;装置A中发生反应的化学方程式为 。
(2)实验1:将U形管放在盛有80℃热水的烧杯中,关闭K2、打开K1,从U形管左端管口鼓入O2.现象:右端裹有白磷的棉花先冒白烟,片刻后开始燃烧,另一端的普通棉花没有变化。实验1可以得出的燃烧条件为 。
(3)实验2:在上述实验1燃烧过程中,关闭K1、打开K2,从U形管左端管口鼓入气体Y.现象:燃烧着的棉花团很快熄灭,停止燃烧:继续鼓入气体Y,装置C中澄清石灰水变浑浊。写出C中反应的化学方程式 ;装置D中注射器内盛放的试剂X可能为 。
(4)实验3:关闭K2、打开K1,再次鼓入O2,发现右端剩余的裹有白磷的棉花又能燃烧。对比实验2和3,可以得出的燃烧条件为 ;实验2同时能证明气体Y的性质为 ,利用该性质可用于 。
(5)该实验的优点为 。
长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁。某研究性学习小组为测定水垢中碳酸钙的质量分数,利用图Ⅰ装置将足量的盐酸加入到10.0g水垢中。随反应进行,装置C质量的变化如图Ⅱ所示。请回答:
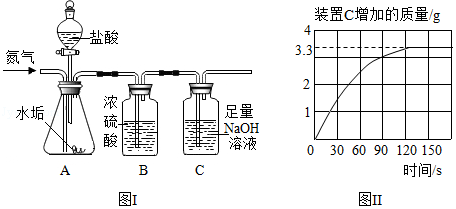
(1)向图I装置A中不断通入氮气的目的是 ;
(2)若不考虑盐酸的挥发和水垢中含有其他成分,请根据图Ⅱ数据计算:
水垢中碳酸钙的质量是 ,水垢中氢氧化镁的质量分数是 ; (不要求计算过程,精确到0.1)
(3)若考虑盐酸的挥发,会造成水垢中碳酸钙质量分数的测量结果 (填“增大”“减小”或“不变”)。