实验室有一份部分被氧化成氧化镁的镁粉样品,未知浓度盐酸和40%的氢氧化钠溶液,兴趣小组同学为分析样品中金属镁的质量分数含量和计算盐酸的质量分数,进行如下探究:
(1)用盐酸溶解样品(样品混合均匀),测定生成氢气质量,实验数据如表所示:
实验序号 |
所取样品质量(g) |
所加盐酸质量(g) |
生成氢气质量(g) |
Ⅰ |
16.0 |
60.0 |
0.5 |
Ⅱ |
16.0 |
130.0 |
1.0 |
Ⅲ |
16.0 |
150.0 |
1.0 |
镁粉样品中金属镁的质量百分含量为 。
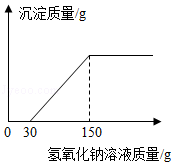
(2)向实验Ⅲ后的溶液中加入40%的氢氧化钠溶液,生成沉淀的质量随加入氢氧化钠溶液质量的变化关系如图所示。计算盐酸的质量分数。(写出计算过程)
下列实验装置常用于制取和收集气体。

(1)实验室制取二氧化碳气体所选择的发生装置是 (填字母序号,下同),收集装置是 ,检验二氧化碳是否收集满的方法是 ;若用C装置来干燥二氧化碳气体,C装置中应盛放的物质是 。
(2)写出一个用A装置制取氧气的化学方程式 ;
(3)若用A、D装置组合制取氧气,下列实验操作正确的是 (填序号);
①开始加热时,导管口出现气泡立即收集
②停止加热时,先熄灭酒精灯,再将导管移出水面
③在装药品前,先检查装置的气密性
(4)若要用C装置盛满水来收集氧气,则气体应从 端进入(填“a”或“b”)。
某学习小组欲测定刚配制的BaCl2溶液中溶质的质量分数,采取下列两种方法:
方法1:取100gBaCl2溶液,加入适量的AgNO3溶液,两者恰好完全反应,并测得生成AgCl沉淀的质量为m1g;
方法2:取100gBaCl2溶液,加入m2g溶质的质量分数为a%的Na2SO4溶液,恰好使BaCl2溶液完全沉淀;
已知相关物质的相对分子质量:BaCl2=208 Na2SO4=142 AgCl=143.5
(1)请任选一种方法计算该BaCl2溶液中溶质的质量分数(写出详细的计算过程);
(2)如果采取上述两种方法,可推知a= (用含m1、m2的代数式表示)
某化学兴趣小组为探究复分解反应能否发生,进行了如下实验:
|
实验编号 |
① |
② |
③ |
|
物质 |
NaOH溶液 |
Na2CO3溶液 |
BaCl2溶液 |
|
加稀硫酸后的现象 |
无明显现象 |
|
白色沉淀 |
(1)实验②中的现象是 .
(2)小杨同学认为实验①不反应,小康同学不同意小杨同学的观点,认为无明显现象并不代表没有发生反应.
经小组讨论,设计如下实验来探究稀硫酸与NaOH溶液能否发生反应.

观察到上述实验试管中的现象 (选填“红色消失”或“红色不消失”),说明稀硫酸与NaOH溶液发生了反应,该反应的化学方程式为 .
(3)反应后,同学们将所有废液倒入同一烧杯中,静置,烧杯中有白色沉淀,溶液呈无色,该无色溶液中一定含有的溶质(除酚酞外)是 (填化学式)
如图为教材中实验室模拟炼铁的实验改进装置(部分夹持仪器略去)。
实验步骤如下:
Ⅰ.连接好装置,并检查装置的气密性;
Ⅱ.装好药品,先通一会儿CO,再点燃酒精喷灯;
Ⅲ.实验结束,先撤去酒精喷灯,继续通CO直至玻璃管冷却:
回答下列问题:
(1)实验中可看到A处玻璃管里的粉末由红色逐渐变黑,说明Fe2O3转化为 (填化学式),B瓶中澄清石灰水变浑浊,该反应的化学方程式为 。
(2)步骤Ⅲ中先撤去酒精喷灯,继续通CO直至玻璃管冷却的目的是 。
(3)盛满石灰水的B装置在此实验中的作用有下列说法:
①收集多余的CO
②检验并吸收反应生成的CO2
上述说法中正确的
A.只有①B.只有②C.是①和②

分析处理图表中的信息是学习化学的一种重要方法,如表是NH 4Cl和KNO 3在不同温度时的溶解度数据:
|
温度/℃ |
10 |
30 |
50 |
70 |
|
|
溶解度/g |
NH 4Cl |
33.3 |
41.4 |
50.4 |
55.2 |
|
KNO 3 |
20.9 |
45.8 |
85.5 |
110 |
|
根据上述数据,回答下列问题:
(1)从上表可知,50℃时,NH 4Cl的溶解度为 g.
(2)NH 4Cl和KNO 3的溶解度受温度影响比较大的物质是 (填化学式).
(3)欲配制质量分数为10%的KNO 3溶液,需要的玻璃仪器有烧杯、量筒、胶头滴管和 .
(4)烧杯中A中是60℃时,含有100g水的NH 4Cl不饱和溶液,经过如图1的变化过程
(在整个过程中,不考虑水分的蒸发),则C烧杯中溶液的质量为 g 
(5)某同学欲验证NH 4Cl固体溶于水时吸收热量,设计如图2实验,通过观察到 现象得以验证.
A.a端液面高于b端液面
B.a端液面低于b端液面.