有一包白色粉末,可能由CuSO4、Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种组成,同学们查阅资料得知NaCl、CaCl2、BaCl2等溶液呈中性,经过思考,设计并进行了以下实验:

(1)白色粉末一定不含 ,可能含有 。
(2)为了确定白色粉末的组成,还需要对无色滤液中呈碱性的物质进行探究。
[提出问题]无色滤液中呈碱性的物质是什么?
[猜想假设]猜想一:NaOH
猜想二:
猜想三:Na2CO3和NaOH
[进行实验]
实验步骤 |
实验现象 |
结论 |
1.取少量该溶液于试管中,滴入 溶液。 |
|
猜想三正确 |
2.静置上述溶液,取少量上层清液于另一试管中,滴入几滴 溶液。 |
|
步骤1中发生反应的化学方程式为 。
[得出结论]白色粉末的成分是 。
实验室利用如图所示装置制取CO2并进行相关实验。回答下列问题:
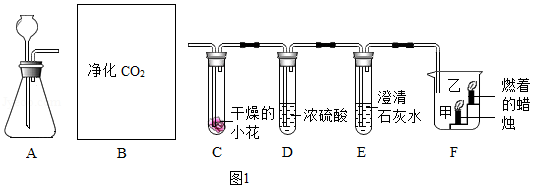
(1)A中反应的化学方程式为 。
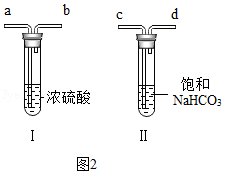
(2)B中需连接如图2所示装置Ⅰ、Ⅱ,为得到纯净CO2,装置Ⅰ、Ⅱ的导管口沿气体流动方向的连接顺序是 。装置Ⅱ中饱和NaHCO3溶液的作用是 。
(3)C中放置的是石蕊溶液染成紫色的干燥的小花,实验过程中小花的颜色 (填“变红”“变蓝”或“不变色”)。
(4)E中澄清石灰水变浑浊反应的化学方程式为 。
(5)F中先熄灭的蜡烛是 (填“甲”或“乙”)。
二氧化硫属于空气污染物,应处理后排放。32g硫与足量的氧气完全反应,生成二氧化硫的质量是多少?
某化学兴趣小组的同学对酸、碱和盐的性质进行探究,请你参与。
[查阅资料]CO2+Na2CO3+H2O═2NaHCO3;
20℃时,部分物质的溶解度。
|
物质 |
Ca(OH)2 |
NaOH |
Na2CO3 |
NaHCO3 |
|
溶解度/g |
0.16 |
109 |
21.8 |
9.6 |
探究一:探究氢氧化钙的性质
20℃时,在盛有5g Ca(OH)2固体的A烧杯中加入40mL水,用玻璃棒搅拌,静置,取上层部分清液于B烧杯中。
(1)向A烧杯中滴加几滴酚酞溶液,观察到的现象是 ,再加入过量稀盐酸,反应的化学方程式为 。
(2)向B烧杯中通入CO2,观察到澄清石灰水变浑浊。
(3)由上述实验可知氢氧化钙的性质有 。
[实验拓展]
(4)向上述(1)反应后的A烧杯中滴加碳酸钠溶液,测得其pH随反应时间的变化如图1.AB段的实验现象是 ,BC段发生反应的化学方程式为 。
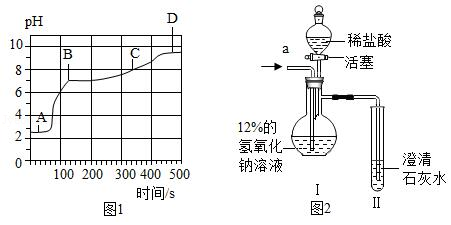
探究二:二氧化碳通入一定溶质质量分数的氢氧化钠溶液中溶质成分的探究
[设计和实验]20℃时,甲、乙两组同学设计如图2装置分别进行实验。
甲组:从a端缓慢通入CO2,一段时间后Ⅱ中变浑浊,停止通CO2,Ⅰ中溶质为X.打开活塞,滴加足量稀盐酸。
[解释与结论](1)经分析X是NaHCO3.实验过程中,Ⅰ中产生的现象是 。
乙组:从a端缓慢通入CO2,一段时间后Ⅱ中无明显现象,停止通CO2,Ⅰ中溶质为Y.打开活塞,滴加足量稀盐酸,Ⅱ中变浑浊。
[解释与结论](2)乙组同学认为Y只有Na2CO3.你认为该结论是否合理,结合分析Y的成分说明理由 。Ⅰ中一定发生反应的化学方程式为 。
常温下,向盛有100.0g KOH溶液的烧杯中逐滴加入120.0g质量分数为7.3%的稀盐酸,用pH计(精确测定溶液pH的仪器)测定反应过程中溶液的pH,所得数据如表:
|
加入稀盐酸的质量/g |
60.0 |
80.0 |
100.0 |
120.0 |
|
烧杯中溶液的pH |
13.7 |
13.3 |
7.0 |
0.7 |
(1)恰好完全反应时,消耗稀盐酸的质量为 g。
(2)求该KOH溶液中溶质的质量分数(结果精确到0.1%)。
某化学兴趣小组在实验室发现一瓶混入Na2CO3的NaOH固体。于是他们对该固体中Na2CO3的含量进行探究。
[查阅资料]Ⅰ.碱石灰是氢氧化钠与氧化钙的固体混合物。
Ⅱ.无水硫酸铜是一种白色固体,遇水会变成蓝色。
[提出问题]该固体中Na2CO3的质量分数是多少?
[反应原理]碳酸钠与稀硫酸反应会生成CO2,反应的化学方程式为 。
[制定计划]同学们设计了两种实验方案(装置气密性良好,浓硫酸、碱石灰均足量)。
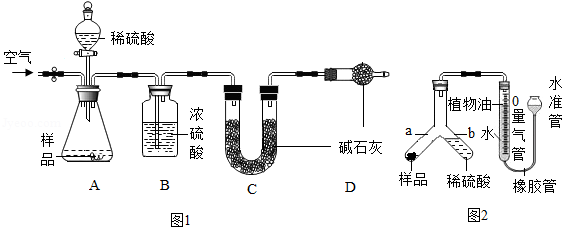
方案甲:用图1所示装置测定反应后生成CO2的质量。称取一定质量的样品于锥形瓶中,通入一段时间空气后,向样品中滴加稀硫酸,待样品反应完全,继续通入一段时间空气后,测出生成CO2的质量,计算。
方案乙:用图2所示装置测定反应生成CO2的体积。称取一定质量的样品,将样品和足量稀硫酸分别置于Y形管a、b处(此时量气管液面在零刻度处),倾斜Y形管,使反应发生,待样品反应完全,测出生成CO2的体积,计算。
[分析与讨论]
(1)方案甲中,浓硫酸的作用是 ;为测出生成CO2的质量,需要在样品反应前后分别称量装置 (填装置序号)的质量。方案乙中,植物油的作用是 ;反应结束后,应 ,然后根据液面读出生成CO2的体积。
(2)小红同学认为方案甲的装置设计还存在一个明显缺陷,可增加图3中的一个装置进行改进,改进后整套装置的连接顺序为 (按气流方向填装置序号)。
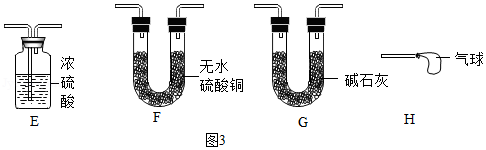
(3)小青同学认为,还可以用“沉淀法”进行测定:称取一定质量的样品放入试管中, ,计算。
[进行实验]同学们在完善实验方案后,测出了该NaOH固体中Na2CO3的质量分数。
[反思与评价]设计实验方案应使实验简便、误差小。