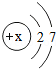小明同学在课外阅读中得知:钠是一种活泼金属,常温下能与氧气,水发生反应,其中钠与水反应的化学方程式为:2Na+2H2O═2NaOH+H2↑,在实验室,该同学选取50ml一定溶质质量分数的硫酸铜溶液于烧杯中,再取绿豆大小的钠投入硫酸铜溶液中,充分反应后过滤,得到滤液和蓝色滤渣,并对滤液的成分进行探究。
[提出问题]滤液中溶质的成分是什么?
[查阅资料]已知Na2SO4的水溶液呈中性。
[猜想与假设]
猜想一:Na2SO4;
猜想二: ;
猜想三:Na2SO4、CuSO4;
猜想四:Na2SO4、CuSO4、NaOH;
其中不合理的是 ;
[实验方案与验证]
实验 |
实验操作 |
实验现象 |
实验结论 |
实验一 |
取少量滤液于试管中,观察现象 |
溶液为无色 |
猜想 成立 |
实验二 |
另取少量滤液于试管中,向其中滴加酚酞试剂 |
无明显现象 |
猜想 成立 |
实验三 |
常温下,再取少量滤液,测溶液酸碱度 |
pH=7 |
猜想 成立 |
[拓展延伸]金属钠在运输、保存中应该注意 。
葡萄糖的化学式为C 6H 12O 6。
(1)一个葡萄糖分子中共有 个原子。
(2)葡萄糖中碳元素和氢元素质量比为 。
(3)葡萄糖中碳元素的质量分数为 。
胃酸过多的病人,通常需每天服用含碳酸氢钠的药物9片,能消耗胃酸中的氯化氢2.19g.某病人有胃溃疡症状,这种药物会加剧胃部疼痛.医生建议改用含氢氧化铝(其他成分不与胃酸反应)的胃舒平,药物标签如图.请计算中和相同质量的胃酸,每天需要服用胃舒平多少片?

如图是实验室用于气体制备的装置,请根据图示回答问题:
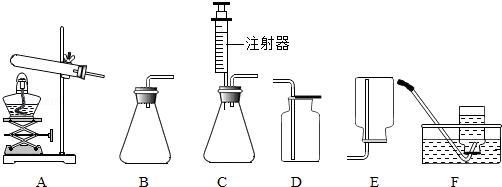
(1)实验室用氯酸钾制取氧气应选择的发生装置是 (填序号,下同).
(2)实验室中能用于过氧化氢溶液制氧气,且便于随时添加液体药品的发生装置是 ;要想得到比较纯净的氧气,需选择的收集装置是 .
(3)实验室制取二氧化碳时,应选择的收集装置是 ,理由是 ;判断CO 2是否收集满的方法是 .
实验室有一瓶标签模糊的烧碱溶液,小杰设计实验测定了其溶质质量分数.请根据如图所示的实验过程和提供的数据进行分析和计算.(注:滴入酚酞试液的质量忽略不计)
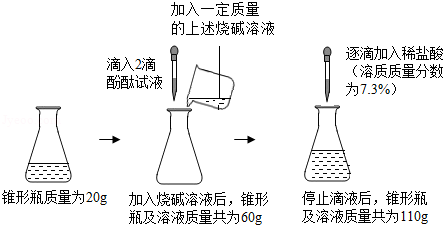
(1)将稀盐酸逐滴滴入锥形瓶的过程中,应边滴加边摇动锥形瓶,当观察到溶液颜色恰好 时,停止滴液,反应所消耗稀盐酸的质量为 g.
(2)通过计算确定该瓶烧碱溶液的溶质质量分数.(写出计算步骤)
(3)问题讨论:小红做同样的实验得到的结果比小杰得到的结果偏小,从实验操作的角度分析产生这种误差的原因可能是 (填写一条即可)
元素的性质与原子结构密切相关,请填空:
(1)氟元素(F)的原子结构示意图如图所示,据图可判断出x的数值为 ;氟原子在化学反应中易 电子(填"得"或"失"),所以氟元素在化合物中的化合价通常为 价.
(2)氢元素与氟元素形成的化合物为氟化氢,其化学式为 ;常温下,氟气(F 2)是一种气体,能与水反应生成氟化氢和氧气,此反应的化学方程式为 .