将8.0g三氧化二铁加入到100.0g的稀硫酸溶液中,恰好完全反应。化学反应方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O.试计算:
(1)硫酸的相对分子质量是 ;
(2)稀硫酸溶液的溶质质量分数(计算结果精确到0.1%)。
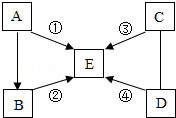
A、B、C、D、E是初中常见的五种物质,其中 D是黑色固体,且与C在一定条件下反应有红色物质生成,E的固体俗称干冰。①、②、③、④的反应类型分别是复分解反应、分解反应、化合反应和置换反应。图中“一”表示两端物质间能发生反应,“→”表示物质间的转化关系,部分反应物、生成物及反应条件已略去。
请回答下列问题:
(1)写出下列物质的化学式:D ,E 。
(2)写出下列反应的化学方程式:
① ;
④ 。
(1)在自来水厂取水口管道入口处设有拦污栅,此处相当于实验基本操作中的 .水厂工人在清理拦污栅的垃圾时经常发现有:①菜叶②纸皮③香蕉皮④易拉罐⑤塑料饮料瓶,其中可回收的有 (填序号).
(2)地球上总水量虽然很大,但淡水资源很少,我们必须爱护水资源,一方面要 ,另一方面要 (从"节水、防治水体污染"两个角度回答的合理答案均得分).
(3)在常温下完全电解90mL的水,正极与负极产生的气体的体积比为 ,产生氧气的质量为 克(设常温下水的密度为1g/cm 3).
Na2CO3和NaHCO3有很多相似的化学性质,例如它们都能与稀盐酸反应生成 气体。某学习小组对它们的鉴别方法产生了探究兴趣。
【提出问题】如何鉴别Na2CO3和NaHCO3呢?
【查阅资料】(1)NaHCO3固体受热分解生成碳酸钠和两种氧化物。
(2)Ca(HCO3)2可溶于水。
(3)通常状况下,NaHCO3是一种白色晶体,溶解度小于Na2CO3的溶解度,饱和的Na2CO3溶液中通入CO2气体,可生成NaHCO3。
【作出猜想】猜想一:可用酚酞溶液鉴别Na2CO3和NaHCO3溶液。
猜想二:可用加热的方法鉴别Na2CO3和NaHCO3固体。
猜想三:可用澄清石灰水鉴别Na2CO3和NaHCO3溶液。
猜想四:可用CO2气体鉴别Na2CO3和NaHCO3溶液。
小组同学一致认为猜想一不正确,理由是 。
【实验探究】请你与小组同学一起探究。
|
实验操作 |
实验现象 |
实验结论 |
|
|
实验1 |
分别取少量的Na2CO3和NaHCO3 固体于试管中加热,并将产生的气体通入澄清石灰水 |
加热Na2CO3时,澄清石灰水无变化;加热NaHCO3时,澄清石灰水变浑浊 |
|
|
实验2 |
分别取少量Na2CO3和NaHCO3溶液于试管中,加入澄清石灰水 |
两支试管中均产生了白色沉淀 |
猜想三 不正确 |
|
实验3 |
往盛有饱和Na2CO3和NaHCO3溶液的两支试管中分别通入足量的CO2气体 |
观察到 |
猜想四 正确 |
【问题讨论】
同学们对实验2的实验现象进行分析。从物质在溶液中解离出不同离子的微观角度分析,Na2CO3溶液与澄清石灰水发生反应的本质原因是 ,该反应的基本类型是 。石灰水与NaHCO3溶液也能反应生成白色沉淀,老师指出其反应原理较复杂,有待于今后学习中进一步探究。
【拓展应用】
除去固体Na2CO3中混有的少量NaHCO3,可用的方法是 (用化学方程式表示)。
某学习小组用图中的仪器或装置制备气体,请回答有关问题:

(1)请写出图中标有序号仪器的名称:① ; ② 。
(2)实验室用高锰酸钾制取氧气的化学方程式为 ,其发生装置可选择 (填序号)进行组装。组装仪器时,将玻璃管插入胶皮管前,先把玻璃管口 ,然后稍稍用力即可把玻璃管插入胶皮管内。
(3)若用E装置收集二氧化碳,验满方法是 。
(4)实验室若用块状固体和液体无需加热制取气体,发生装置可用D或F(有孔塑料板用来放块状固体)。和D相比,F装置的优点是 。
有一包固体X,可能由NH4NO3、FeCl3、NaOH、Na2SO4、CaCO3、Ba(NO3)2中的两种或两种以上物质组成。为探究其成分,进行如下实验:
(1)取少量固体X与熟石灰研磨,无氨味。则原固体中一定不含 。
(2)另取少量固体X按图中的甲进行实验。
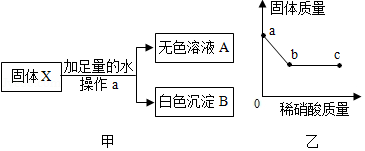
①操作a的名称是 ,由甲实验判断,原固体中一定不含 。
②取白色沉淀B于烧杯中并逐滴加入稀硝酸,烧杯中固体质量随滴入稀硝酸质量的变化如图乙所示。则白色沉淀B的成分为 ,图乙中c点时烧杯中的溶液一定含有的阳离子是 。
(3)为进一步探究原固体X的组成,取无色溶液A,向其中通入CO2气体,产生白色沉淀,由此判断固体X中还含有 。