酸、碱、盐是我们身边重要的化合物,在生活和生产中具有广泛的应用。
(1)锅炉水垢既会降低燃料的利用率,影响锅炉的使用寿命,还可能造成安全隐患。某锅炉水垢的主要成分有CaCO3、Mg(OH)2、Fe2O3,用“酸洗”法可除去该水垢。
①“酸洗”时,一般不选用稀硫酸的原因是 。
②写出稀盐酸与氧化铁反应的化学方程式 。
(2)两种抗胃酸药剂的主要成分及建议每次剂量见表:
主要成分 |
NaHCO3 |
Mg(OH)2 |
建议每次剂量/g |
0.5 |
0.3 |
服用Mg(OH)2的药效比服用NaHCO3“强”的原因是 。
(3)某校化学兴趣小组在课外活动中,对三种溶液进行了检验,检验的结果如表所示:
组别 |
溶液中检验出的物质 |
1 |
CaCl2、NaCl、CaCO3 |
2 |
Ba(OH)2、H2SO4、NaCl |
3 |
KCl、Na2SO4、NaCl |
其中第 组结果肯定不正确。
(4)在CuO和Fe的混合物中加入一定量的稀硫酸,微热,待反应停止后过滤,滤出不溶物后再往滤液里加入一枚铁钉,若铁钉无变化,不溶物中一定含有 ,滤液中含有的溶质是 。
如图是实验室常用来制取气体的实验装置,请根据要求回答下列问题:

(1)仪器a的名称是 。
(2)实验室用氯酸钾和二氧化锰制氧气,选择的发生装置是 ,选择E装置收集氧气,因为氧气不与水反应,并且 ,应将收集满氧气的集气瓶 (填“正”或“倒”)放在桌面上,实验结束后,先将导管撤离水槽,再 。
(3)若选择B装置制取氧气,发生反应的化学方程式为 。
(4)实验室制取二氧化碳选用的发生装置是 ,选择的收集装置是 ,验证生成的气体是二氧化碳的化学方程式为 。
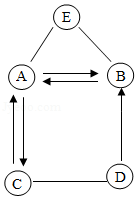
如图A~E是初中化学中五种常见的物质,各物质的转化关系如图所示。已知A俗称苏打,D是人体胃液中主要含有的酸,E可以用来配制波尔多液。其中图中的“﹣”表示相连两物质之间能发生反应,“→”表示一种物质能转化成另一种物质(部分反应物、生成物、反应条件已略去)。根据图示回答下列问题:
(1)E除了能配制波尔多液,还可以用来 。
(2)写出图示中符合下列要求的化学反应方程式:
①A→B的反应: 。
②C与D的反应: 。
③A与E的反应: 。
在实验过程中常会得到混合物,请完成下列问题。
(1)当用稀盐酸和大理石制取二氧化碳时,二氧化碳气体中常混入氯化氢,原因是 。可以用饱和碳酸氢钠溶液吸收氯化氢气体,该反应的化学方程式为 。
(2)过量的铁粉与硫酸铜溶液充分反应后过滤,得到滤渣的成分是 ,向滤渣中加入足量稀硫酸可回收金属铜。上述反应所涉及的化学反应基本类型是 。
掌握化学知识有利于我们更好地生活。
(1)在炎热的夏天,应该把自行车停放在阴凉处,防止因暴晒而爆胎。请用微观粒子观点解释爆胎的原因: 。
(2)家庭使用燃气时要特别注意安全,当发现燃气泄漏时,一定要防止电火花的产生,否则可能发生 现象。
(3)沙漠地区的铁制品锈蚀较慢的原因是 。
(4)主要成分为氧化钙的食品干燥剂与水接触时会对人体造成伤害,因为氧化钙与水反应生成具有腐蚀性的碱溶液,同时还能 。
乙醇俗称酒精,是常见的有机溶剂,在生产生活中有重要的应用。
(1)国家质量技术监督局于2001年发布了《车用乙醇汽油》国家标准。目前丹东地区部分汽车使用乙醇汽油作为汽车燃料,使用乙醇汽油的优点是 (写出一点即可)。
(2)2020年中国人民众志成城抗击新冠肺炎,取得了举世瞩目的胜利。在使用75%乙醇溶液进行消毒杀菌时,使用方法一般为擦拭,如果喷洒可能会 ,乙醇燃烧的化学方程式为 。