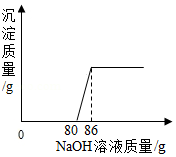
工业盐酸中通常含少量FeCl3而呈黄色。小亮为测定某工业盐酸中HCl的含量进行如下实验,取某工业盐酸50g,滴加溶质质量分数为20%的NaOH溶液,反应过程中,当加入的NaOH溶液质量至以下数值时,对充分反应后所得溶液的质量进行了测定,部分数据如下表,请根据表格和图象完成下列问题:
加入NaOH溶液的质量/g |
25 |
50 |
75 |
100 |
所得溶液的质量/g |
75 |
100 |
125 |
m |
(1)开始没有产生沉淀的原因是 。
(2)求该工业盐酸中HCl的质量分数(写出计算过程)。
(3)m= (结果保留两位小数)。
为了使大众吃得明白、吃得健康,我国规定包装食品必须标注营养成分表,标注的内容包括能量以及4种核心营养素的含量值(碳水化合物即糖类),及其占营养素参考值的百分比(NRV%表示每100克该食品中,所含的营养素占人体一天所需该营养素的百分比)。
如图是某品牌饼干的营养成分表,请回答下列问题:
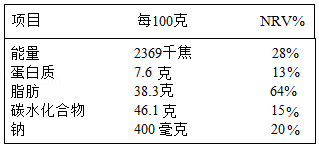
(1)每100克该种饼干中具有2369千焦能量,这些能量不可能来自4种营养素中的 。
(2)钠的过多摄入会引发高血压等慢性心血管疾病,因此国家卫计委推荐每人每天食盐摄入量不超过6克,通过计算判断,按该企业依据的钠营养素标准,若人体摄入的钠全部来自食盐,则人体摄入的食盐量是否合卫计委的要求?(精确到小数点后一位)
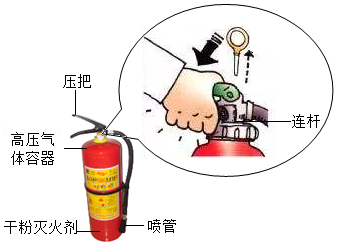
烟头掉落、炉火忘关……,稍不注意就可能引发火灾。如图是某型号的干粉灭火器的结构示意图。
(1)干粉灭火器使用时,拔下保险销,用手握紧压把,通过连杆把高压气体容器打开。“压把”属于 杠杆。
(2)打开高压气体容器后,气体充满整个筒体,粉末状的灭火剂就会喷射出来,此时喷管受到一股反冲力,这是由于 。
(3)某种于粉灭火剂的主要成分是碳酸氢钠。当干粉灭火剂喷射到燃烧区,即能灭火。已知:碳酸氢钠受热分解的化学方程式为:2NaHCO3 Na2CO3+H2O+CO2↑
请结合燃烧的条件,简述该干粉灭火器灭火的原理。
炎热的夏天,某些城市的街道上有雾炮车在向空中喷水,它比普通洒水车的降温、净化空气的效果更好(雾炮车的参数如表所示)
|
雾炮车的部分参数 |
|
|
空载时质量 最大装水量 满载时轮胎与地面的总接触面积 |
6000千克 10000千克 0.4米2 |
(1)雾炮车净化空气主要针对的污染物是 。
(2)雾炮车的降温效果更好,原因是喷出的极细水珠增加了 ,从而加快了水的蒸发。

小明发现某食品包装袋中有一个小袋,上面标有“成分:生石灰、铁粉;作用:防潮、防氧化”等字样。他想了解袋内粉末是否已失效,取少量粉末在水中充分溶解,滴入无色酚酞发现不变色。通过查阅资料获知,常温下铁在空气中不能反应生成Fe3O4和FeO,于是对粉末成分做出如下猜想:
猜想一:可能是CaCO3和Fe;
猜想二:可能是CaCO3和Fe2O3;
猜想三:可能是 。
【实验设计】小明设计了如图所示的实验:

【实验与分析】
(1)向A装置中加入稀盐酸,B装置中出现浑浊现象,证明样品中含有CaCO3。
(2)若粉末中含有Fe,装置E中应观察到的现象是 。
【评价与反思】
上述实验中,如果将E装置去掉,是否还能验证粉末中含有Fe,请说明理由 。
在学校组织的科学实验考查中,小明抽到的是用高锰酸钾制取氧气的实验。

(1)他看到实验桌上有如图所示的器材,要完成本实验,除选取①②③④⑤器材外,还需 (填序号)。
(2)小明组装装置后,开始制取并收集氧气,实验结束时出现了水槽中的水倒流进入试管的现象,他在操作中的错误是 。