根据下列实验装置图,按要求回答下列问题:

(1)仪器a的名称是 。
(2)实验室用高锰酸钾制取氧气,反应的化学方程式是 ,应选用的发生和收集装置是 (填字母序号)。
(3)小明同学用F装置验证二氧化碳的性质,当通入二氧化碳一段时间后,试管①中产生的现象是 ;试管②中的澄清石灰水变浑浊,反应的化学方程式是 。G中观察到蜡烛由低到高依次熄灭,说明二氧化碳具有的性质是 。
冬季雾霾频发,某校社会实践小组的同学们,对某地区雾霾的成分、成因、危害及防治产生了浓厚的兴趣并开启了项目性学习之旅。
[信息检索]雾是浮游在空中的大量微小水滴。霾是可吸入颗粒物浓度较高造成的能见度较低的现象。霾的主要成分可能含有可溶性硫酸盐、硝酸盐,铵盐、不溶性有机物、黑碳、金属元素和其它元素。
[提出问题]某地霾的成分是什么?
[实验准备]选择该地重度雾霾天气,用SDLKC﹣1000型大流量TSP采样器在室外采集大气中的可吸入颗粒物10g。
活动一:探究霾中是否含有铵盐和硫酸盐。
|
实验方案 |
实验步骤 |
实验现象 |
实验结论 |
|
方案一 |
取5g样品,加少量熟石灰末,混合、研磨 |
|
含有铵盐 |
|
方案二 |
取5g样品,加适量水,充分溶解后过滤,向滤液中滴加 |
有白色沉淀生成 |
含有硫酸盐 |
[总结反思]工业上应加强对污染企业的监管,农业上应合理施用化肥。
活动二:探究霾中是否含有黑碳。同学们设计了如图所示的创新实验。(将活动一得到的残渣,干燥后置于中间凹槽内)
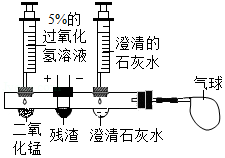
[实验步骤]①滴入过氧化氢溶液制取O2,排出装置内空气后,再在导管口接上气球。
②向右边的凹槽内滴入澄清的石灰水,
③接通电源,用热电阻丝点燃残渣
[实验现象]残渣剧烈燃烧,澄清石灰水浑浊,气球变大。
[实验结论]霾中含有黑碳。装置内澄清石灰水变浑浊的化学方程式是 。
[交流研讨]某同学对“霾中含有黑碳”的结论产生质疑,理由是 。
活动三:查阅资料,霾中还含有Al、Na、Zn、Pb、Hg、Cd等金属元素,其中的有害元素除Cd外,还有 。
[能力发展]请你联系实际填写关于雾霾的问卷调查表:
|
项目 |
雾霾频发的成因 |
控制雾霾频发的做法 |
政府采取的应急措施 |
|
① |
能源结构不同 |
推广太阳能发电 |
人工降雨 |
|
② |
烧散煤取暖 |
|
向空中或地面洒水 |
|
③ |
|
推广新能源汽车 |
私家车限号出行 |
[检出进度]小组同学没有进行的探究项目是 。
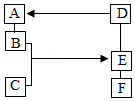
A~F是六种不同物质,A是单质,C和E都是酸,它们之间的反应关系如图所示(部分物质已略)分析辨识,解决问题:
(1)B和C反应的化学方程式是 .基本反应类型是 .
(2)D生成A的化学方程式是 (写一个).
(3)若F与其他物质类别不同,E和F反应的微观实质是 .
港珠澳大桥
港珠澳大桥连接香港、珠海和澳门,它是采用桥、岛、隧结合的方案进行建造的。全长约为55km,海中主体工程长29km。使用寿命约120年,可抗2级台风和8级地震。这是目前世界上规模最大、标准最高、挑战性最强的交通集群工程。大桥钢索、桥面和桥墩等均使用了大量金属村料。钢筋混凝土沉管隧道是港珠澳大桥的控制性工程,为满足通航要求,沉管底深埋于海面以下深处可达且44.5m,是目前世界上唯一的深埋沉管隧道工程。燧道内不仅可通车,还可餐饮、休闲和加油等。承载沉管隧道的海床由坚硬的花岗岩(主要成分是二氧化硅)、云母(主要含二氧化硅、氧化铝等)等种圹物组成。
阅读上述内容,回答下列问题:
(1)金属材料在被制成桥上的钢索和钢板时体现了金属的 性。
(2)沉管在海洋环境中应具备的特性是 、 (合理即可)。
(3)海床矿物中含有的一种物质的化学式是 ,它属于化合物分类中的 。
(4)沉管隧道内的加油站应张贴的安全标志是 (合理即可)(写一个),目的是 。(合理即可)
黄铜(铜锌合金)的外观与黄金极为相似,容易以假乱真。小红同学想测定黄铜中锌的含量。她称取20g黄铜样品放入烧杯中,加入足量稀硫酸充分反应后,测得生成氢气的质量为0.2g。
(1)该反应属于 (填基本反应类型)。
(2)求黄铜中锌的质量分数。(写计算过程)
化学实验过程经常会产生定量的废液,经过无害化处理可有效防止水体污染。在一次实验课上,兴趣小组的同学们完成了NaOH溶液和Na2CO3溶液的鉴别,并对废液成分展开探究。
活动一 通过小组合作,同学们完成了如图所示的三组小实验。实验中生成白色沉淀的化学方程式是 (写一个)。

活动二 小雪将六支试管中的剩余物倒入一个洁净的大烧杯中( 如图),充分搅拌、静置,观察到杯内上层是无色溶液,下层有白色沉淀。由此可以确定:上层溶液中一定不含有的离子是 、以及一定含有的离子。小组同学对上层溶液中还可能含有的离子进行了如下探究。

[提出问题]上层溶液中还可能含有什么离子?
[猜想与假设]上层溶液中还可能含有OH﹣、CO32﹣、Ca2+中的一种或几种。
[进行实验]
|
实验步骤 |
实验现象 |
实验结论 |
|
|
方案一 |
①取少量溶液于试管中,滴加无色酚酞溶液 ②继续滴加稀盐酸 |
①溶液变红 ②产生气泡 |
①有OH﹣ ②有CO32﹣无Ca2+ |
|
方案二 |
取少量溶液于试管中, (合理即可)(指示剂除外) |
(合理即可) |
①有CO32﹣,无Ca2+②有OH﹣ |
[反思与评价]
(1)经过综合分析,最终确定上层溶液中肯定存在的离子有 。
(2)将烧杯内物质过滤,滤渣回收,向滤液中加入适量 ( 合理即可)进行处理后再排放。