为探究酸的化学性质,某化学小组利用盐酸进行了如下实验操作:
实验 |
|
|
|
|
|
请回答:
(1)写出E中反应的化学方程式 。
(2)将反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行如下探究:
[提出问题]滤液中溶质的成分是什么?
[作出猜想]
猜想一:NaCl
猜想二:NaCl和CaCl2
猜想三:NaCl、CaCl2和Na2CO3
猜想四: 。
[进行讨论]经过讨论,同学们一致认为猜想 是错误的。
[设计实验]请完成实验报告。
实验步骤 |
实验现象 |
实验结论 |
取少量滤液于试管中,滴加适量的碳酸钠溶液 |
无明显现象 |
猜想二不成立 |
取少量滤液于试管中,滴加氯化钡溶液 |
|
猜想四成立 |
[反思拓展]在分析化学反应后所得物质的成分时,除考虑生成物外还需考虑 。
金属具有广泛的应用。
(1)下列金属制品中,利用金属导热性的是 (填字母)
A.金属硬币 B.铝制导线 C.铜制火锅
(2)波尔多液是一种农业上常用的杀菌剂,它由硫酸铜、生石灰加水配制而成,不能用铁质容器配制波尔多液的原因是 (用化学方程式表示)
(3)防止金属锈蚀是保护金属资源的有效途径之一。洁净的铁钉在下列情况下容易生锈的是 (填字母)。
A.在干燥的空气中 B.在潮湿的空气中 C.浸没在植物油中
(4)铝具有良好的抗腐蚀性能,原因是铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化。氧化铝难溶于水,却能溶于酸。写出氧化铝与稀硫酸反应生成硫酸铝和水的化学方程式 。
(5)向铁粉和氧化铜粉末的混合物中加入一定量的稀硫酸,微热,充分反应后过滤,得滤渣和滤液。 向滤液中加一洁净铁片, 未看到铁片有任何变化。则滤液中含有的溶质是 (填化学式),滤渣中一定含有的物质是 (填化学式)
在下列转化关系中,各物质均是初中化学常见物质,其中甲、乙、丙属于单质,A为黑色固体,C属于盐.
①甲+乙  B ②甲+丙
B ②甲+丙  A
A
③A+D→C+B ④C+E→Cu(OH) 2↓+NaCl
回答下列问题:
(1)用化学式表示:乙 ;B .
(2)反应②的化学方程式为 .
(3)反应④的化学方程式为 .
写出下列反应的化学方程式
(1)碳在氧气中充分燃烧 ;
(2)镁和稀硫酸反应 ;
(3)碳酸钠溶液与澄清石灰水混合 .
实验室有氧化铜和铁的混合粉末,为提炼其中的铜,取等质量样品,分别进行了两个实验。
实验一
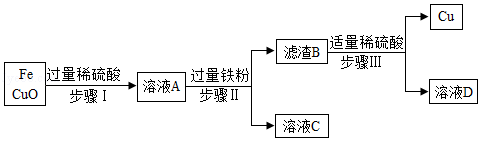
①分离得到溶液C的操作名称是 。
②写出步骤II中反应的化学方程式 。
③上述步骤 (选填步骤编号)所包含的反应体现了铁的活动性比铜强。
实验二
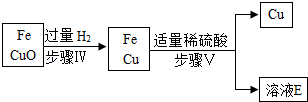
④写出步骤Ⅳ中反应的化学方程式 。
⑤D、E是同一种溶质形成的溶液,请写出该溶质的名称,判断能否得出D、E溶液中该溶质质量的大小关系并说明理由。
实验室制备二氧化碳的实验如下:

①市售浓盐酸的标签局部见图1,该盐酸中HCl质量分数的范围是 .为使制备过程中二氧化碳平稳地产生且较纯净,应将该浓盐酸 .
②用甲装置制备二氧化碳,选择的固体药品是 (选填编号).
a.粉末状石灰石 b.块状大理石 c.粉末状熟石灰 D.块状生石灰
③控制所加盐酸的量,使反应时甲装置内液面位于 处(选填"x"或"y")为宜.
④收集二氧化碳,应将甲的 处于乙的 处连接(选填有关编号).
⑤写出用澄清石灰水检验二氧化碳的化学方程式 .
⑥反应生成了0.1mol二氧化碳,求稀盐酸中参与反应的HCl的质量.(根据化学方程式列式计算) .