某化学学习小组的同学对一瓶敞口放置氢氧化钙固体的化学成分产生了兴趣,他们根据自己所学知识进行如下探究:
【提出问题】该瓶药品的化学成分是什么?
【查阅资料】(1)氢氧化钙能与空气中的二氧化碳反应而变质。
(2)氢氧化钙的溶解度曲线如图。
【猜想假设】猜想一:Ca(OH) 2
猜想二:
猜想三:CaCO 3
【实验验证】
实验操作 |
实验现象 |
实验结论 |
(1)取1g样品放入盛有50g水的烧杯中,充分搅拌后,静置 |
烧杯底部有较多固体未溶解 |
样品中含有CaCO 3 |
(2)取实验(1)中上层淸液少许于试管中,再向试管中滴加2~3滴无色酚酞试液 |
|
样品中含有Ca(OH) 2 |
【得出结论】甲同学认为猜想二正确。
【反思交流】
(1)乙同学认为甲同学的结论不合理,他认为猜想 也可能正确,原因是 。
(2)丙同学认为要想验证猜想二正确,还需做如下实验:取实验(1)中未溶解固体于试管中,向试管中滴加适量稀盐酸,如有 ,则猜想二正确。
【拓展提升】要想验证反应后物质的成分,除需验证有生成物以外,还应考虑反应物是否 。

化学源于生活,与工农业生产密切相关。
(1)空气是一种宝贵的自然资源。
①食品包装中充N2以防腐,是由于N2 。
②法国化学家拉瓦锡用 (填“定性”或“定量”)的方法研究了空气的成分。
(2)水作为一种化学物质,能参与许多反应。
①铁制品锈蚀是铁与空气中的 、水蒸气等发生化学反应的结果。
②NaCl溶液能导电,是因为NaCl在水分子的作用下,解离出 。
(3)合理膳食,均衡营养使我们更健康。某食品包装袋上的部分说明如图。
①在饼干配料中,富含油脂的是 。饼干要置于阴凉干燥处,从变化的角度看,是为了 (填“加快”或“减慢”)氧化的速度。
②在农业上碳酸氢铵可用做 肥,但不能跟碱性物质混用,原因是 。

向20g铜锌合金中不断加入一定溶质质量分数的稀盐酸,加入稀盐酸的质量与固体质量的关系如图所示。请计算:
(l)合金中锌的质量分数为 。
(2)所用稀盐酸的溶质质量分数。(计算结果保留一位小数)

厨房中使用的食用碱(主要成分碳酸钠)中往往含有少量的氯化钠,化学兴趣小组的同学通过实验来测定某品牌的食用碱样品中碳酸钠的质量分数。他们实验的过程和数据如图所示。

计算:该食用碱中碳酸钠的质量分数是多少?(计算结果精确至0.1%)
儿童缺锌会引起食欲不振、发育不良等症状。如图为某补锌口服液说明书的部分信息,图中葡萄糖酸锌化学式已不完整,请根据相关信息回答下列问题:
(1)葡萄糖酸锌的化学式量是455,则葡萄糖酸锌化学式氢原子右下角的数字为 ;
(2)若儿童lkg体重每日需要0.5mg锌,每天从食物中只能摄入所需锌的一半。体重为20kg的儿童,理论上一天还需服该口服液 支?

某化学兴趣小组的同学,通过咨询老师准备用亚硫酸钠溶液与浓硫酸反应来制备一定量的SO2 (Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O)。老师给他们提供了一瓶亚硫酸钠溶液并告知该瓶溶液放置时间可能较长,不知是否变质。兴趣小组的同学分成甲、乙两小组对该瓶亚硫酸钠溶液成分进行实验探究。
【提出问题】①该瓶溶液中溶质的成分是什么?
②该瓶溶液中亚硫酸钠的质量分数是多少?
【查阅资料】
(1)Na2SO3有较强还原性,在空气中易被氧气氧化:2Na2SO3+O2═2Na2SO4;
(2)Na2SO3能与酸反应产生SO2气体;
(3)SO32﹣、SO42﹣均能与Ba2+反应产生白色沉淀,BaSO3可溶于稀盐酸。
【作出猜想】
猜想1:没有变质,成分是Na2SO3;
猜想2:完全变质,成分是Na2SO4;
你认为还可能有的猜想3 。
【实验探究Ⅰ】甲、乙两组分别进行实验探究溶液是否变质:
|
小组 |
实验操作 |
现象 |
结论 |
|
甲组 |
取少量样品于试管中加入过量稀盐酸; |
产生气泡 |
没有变质,还是Na2SO3 |
|
乙组 |
取少量样品于试管中加入氯化钡溶液,再加入足量稀盐酸。 |
|
已部分变质 |
【评价】有同学质疑甲组方案不合理,理由是 。
【实验探究Ⅱ】
甲组设计如下实验测定Na2SO3溶液的溶质质量分数。(注:空气中二氧化碳的影响忽略不计)
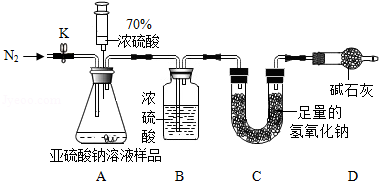
(1)连好装置并检查装置气密性,在锥形瓶中放入126g该样品;
(2)实验前称量C装置的质量;
(3)关闭活塞K,用注射器推入浓硫酸至不再产生气泡;
(4)打开活塞K,缓缓鼓入一定量的氮气,关闭活塞K;
(5)再次称量C装置的质量发现比反应前增重6.4g
由此,计算出该溶液中Na2SO3的质量分数为 ;
【解释】若没有进行第4步操作,则测得亚硫酸钠溶液的溶质质量分数比实际的 (填“偏小”或“偏大”)。
乙组仍使用第一次实验的原理,进行如下实验测定Na2SO3溶液的溶质质量分数。
第一步:称取试样ag;
第二步:在溶液中加入过量氯化钡溶液和足量稀盐酸;
第三步:过滤、洗涤、烘干沉淀;
第四步:称量沉淀的质量为bg;
第五步:计算溶液中Na2SO3的溶质质量分数。
试完成下列问题:
(1)加入氯化钡溶液过量的目的是 。
(2)第三步操作要洗涤沉淀的原因是 。
【反思】由此可得出,保存亚硫酸钠时应 。