实验室开放日,化学小组的同学来到实验室,对酸的性质很感兴趣,向老师提出研究硝酸的性质,老师高兴答应并带领同学们进行了硝酸性质的实验探究。
[实验设计]
(1)将石蕊试液滴入稀硝酸中,预计石蕊试液由紫色变 色;
(2)将Zn片投入稀硝酸中,预计将产生氢气。
[实验验证]同学们按上述设计做了实验,却发现石蕊变色后一会儿即褪去,Zn片投入稀HNO3后,溶液中冒出气泡,产生无色气体A,在试管口气体A变成红棕色有刺激性气味的气体B。
[提出问题]
(1)石蕊试液变色后为何会褪色?
(2)上述产生的无色气体是什么?硝酸具有哪些特性?
[查阅资料]看到如此异常的现象,在老师的指导下,同学们上网查到了下列资料:
(1)硝酸可与Zn、Cu等多种金属反应生成相应的硝酸盐,但不生成H2。
(2)含氮元素的某些气态物质的物理性质
NH3 |
N2 |
NO |
NO2 |
|
颜色 |
无色 |
无色 |
无色 |
红棕色 |
溶解性 |
极易溶于水 |
不溶于水 |
不溶于水 |
可溶于水或硝酸 |
[猜想与分析]
(1)小明同学认为石蕊变色后又褪色的原因是由于试管不干净,含有其他杂质造成的,要证明小明的观点,应进行的操作是
(2)大家一致认同了红棕色气体B是NO2,但对于无色气体A及变化的原因有不同的看法:
①小丽同学认为A是NH3,但遭到了大家的一致反对,原因是 ;
②小强同学认为A是N2,也遭到大家的一致反对,原因是 ;
③经讨论,最终大家获得了A是NO,NO在试管口遇氧气生成NO2的共识。
[实验探究]小红同学对硝酸与Cu反应很感兴趣,便取了一小块Cu片投入稀HNO3中,发现Cu片溶解,也出现了上述Zn与稀HNO3反应的类似现象,确认生成了NO,并在老师的帮助下,测出恰好反应的Cu和HNO3的质量比为8:21,由此获得了Cu与稀HNO3的反应化学方程式 。
[交流与反思]根据探究结果,请你解释稀HCl跟Cu不反应而稀HNO3却能跟Cu反应的原因 。
某兴趣小组为探究锡纸中的金属成分(锡纸中以一种金属为主,其它成分对实验无干扰),开展了以下探究活动。
【提出问题】锡纸中的金属是什么?
【建立猜想】根据锡纸有银白色金属光泽,并结合金属活动性、价格等因素,猜想其中的金属可能是锌、铁、铝、锡中的一种。
【探究过程】
|
步骤 |
活动内容 |
收集证据 |
分析并得出结论 |
|
步骤一 |
①查阅资料:金属锌在室温下很脆 |
锡纸未破损 |
锡纸中金属不是锌 |
|
②取锡纸反复折叠 |
|||
|
步骤二 |
用磁铁靠近锡纸 |
锡纸没有被磁铁吸引 |
锡纸中金属不是 |
|
步骤三 |
①取锡纸条放入浓度为20%的盐酸中除去可能存在的氧化膜。当观察到 现象时,取出锡纸条并用蒸馏水清洗。 ②将处理过的锡纸条放入试管中,加入饱和硫酸锌溶液,静置观察。 |
②中锡纸条表面无明显现象 |
说明锡纸中的金属活动性比锌弱,则锡纸中金属不是铝,而是锡。 |
【交流评价】
小科对实验结论提出质疑:“无明显现象”并不代表没有发生反应,因为铝与硫酸锌反应[2Al+3ZnSO4=3Zn+Al2(SO4)3]生成的金属锌为银白色,与铝颜色相同,因此无法得出结论。请在不改变反应原理的前提下运用定量方法完善实验方案,并根据预期结果得出相应结论: ;
。
【继续探究】运用完善后的方案进行实验,分析实验结果,得出初步结论:锡纸中金属是铝。
1674年,英国化学家约翰•梅猷为测定空气中的氧气含量开展如下实验(装置如图甲)。
I.将一根长度等于玻璃钟罩最宽部分直径的铁棒橫放在钟罩里,把装有稀硝酸的陶罐通过铁钩挂在铁棒上,用绳索将小铁块悬挂在陶罐的正上方(铁块的升降通过在钟罩外拉动或放松绳索来实现)。

Ⅱ.调整水槽中初始水位如图乙,再使铁块浸入稀硝酸中,观察到铁块表面迅速产生大量气泡,钟罩内水面下降。[稀硝酸有强氧化性,能与铁发生如下反应:4HNO3+Fe═Fe(NO3)3+NO↑+2H2O]
Ⅲ.当水位降至接近钟罩口时(如图丙),立即取出铁块,以防气体外逸。
IV.等待一段时间后,水面稳定在如图丁的位置。(一氧化氮会与氧气等物质发生如下反应:4NO+3O2+2?=4HNO3)
分析与评价:
(1)步骤Ⅳ中的“?”处应填 。
(2)从图丙到图丁过程中,钟罩内水位上升的原因是 。(忽略温度变化的影响)
(3)小科重复了上述实验,虽实验时装置气密性良好,且钟罩内液面上方气体体积均能精确测量(即测定气体体积的误差忽略不计),但经过多次实验测定,发现每次测得空气的含氧量都小于 ,原因是 。
实验室有一份在空气中潮解变质的氢氧化钠样品,质量为1.5g某实验小组将这份样品完全溶解,配成50g溶液,然后缓慢滴入7.3%的稀盐酸,同时进行搅拌,使二氧化碳全部逸出。滴加过程中,多次测得溶液pH和溶液总质量,部分数据如下表所示:
|
测量次数 |
第1次 |
第6次 |
第16次 |
第21次 |
第26次 |
|
滴加的盐酸总质量/g |
0 |
5 |
15 |
20 |
25 |
|
溶液总质量/g |
50 |
55 |
m |
69.78 |
74.78 |
|
溶液pH |
12.4 |
12.1 |
7.0 |
2.2 |
2.1 |
请分析计算:
(1)第 次测量时,溶液中只有一种溶质。
(2)表中m= 。
(3)样品中碳酸钠的质量分数。(计算结果精确到0.1%)
(4)1.5g样品中氢氧化钠固体的质量。
氯霉素属于广谱抗生素,能杀灭细菌,但摄入过多容易导致血液疾病,所以国家严令禁止在食品中使用。今年,广州市有关部门在抽检中发现,有些不法商向黄金贝、花蛤等海产品中添加氯霉素,来延长海鲜的存活期。这种滥用氯霉素的现象引起了市民的警觉。
(1)氯霉素性质稳定,不易分解,这种性质属于 (填”物理”或“化学”)性质。
(2)氯霉素(化学式为C11H12Cl2N2O5)中碳元素和氧元素的质量比为 。
常温下,铁在潮湿的空气中容易生锈,产物主要为Fe2O3•nH2O;铁丝在氧气中燃烧,产物为黑色Fe3O4.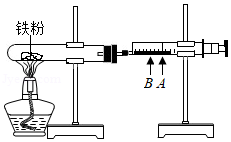
【提出问题】铁在空气中用酒精灯加热时,是否与空气中氧气发生反应?产物是什么?
【查阅资料】①常见的铁的氧化物有三种:FeO、Fe2O3、Fe3O4,其中Fe3O4是磁性物质。
②FeCl3溶液呈黄色,FeCl2溶液呈浅绿色。
【探究】①按图连接实验装置,检查★。向试管内加入铁粉,针筒活塞停在A刻度。
②加热铁粉的过程中,活塞发生移动。停止加热后,活塞逐渐向左移动,最终停在B刻度。
③用细线吊着洁净铁钉靠近加热后的固体粉末,发现没有粉末被铁钉吸上来。
④向试管内加入盐酸,发现有气泡产生,溶液立即出现黄色。
⑤另取一些未加热过的铁粉加入到盛有盐酸的试管内,发现有气泡产生,溶液变为浅绿色。经检验,步骤④、⑤产生的气体相同。
【实验结论与反思】
(1)步骤①中“★”处应填: 。
(2)步骤④、⑤中产生的气体是 。
(3)本实验探究的结论是:铁粉在空气中用酒精灯加热时,与空气中氧气发生反应,产物是 。
(4)结合已学知识和本次探究分析可得,铁与氧气反应的产物受反应温度,氧气的 等因素影响。