根据下列装置,回答问题:

(1)写出图中标号仪器的名称:① ;② .
(2)实验室用过氧化氢溶液和二氧化锰制取氧气时,发生反应的化学方程式为 ,从控制反应速率和节约药品的角度考虑,发生装置最好选用 (填装置序号).
(3)因为氧气不易溶于水,所以可以利用装置 (填装置序号)收集,如果要做铁丝在氧气中燃烧的实验,用这种装置收集氧气时应注意 .
李老师在《燃烧的条件》教学中,改进了教材中的实验,如图所示,在铜片上罩上烧杯,请回答:
(1)罩上烧杯的作用是 ;
(2)能说明燃烧条件之一是温度达到可燃物着火点的实验现象是 。
(3)热水的作用是 。

请你根据所学知识并结合如图所示装置回答有关问题:

(1)指出标号仪器的名称:① .
(2)用氯酸钾和二氧化锰共热制氧气的化学方程式是 ,用C装置收集氧气不纯的原因是 (写一点即可).
(3)制取并收集一瓶干燥的二氧化碳气体,所选装置接口的连接顺序是 (填字母),判断二氧化碳是否收集满的方法是 .
某化学小组欲配制49g溶质质量分数为20%的稀硫酸来进行实验,老师为他们提供了溶质质量分数为98%的浓硫酸(密度为1.84g/cm 3).
(1)通过计算,需要用到溶质质量分数为98%的浓硫酸的质量是 g.
(2)量取浓硫酸时仰视读数(其他操作正确),则配制的稀硫酸的溶质质量分数 (填"大于"、"小于"或"等于")20%.
(3)A和B是两个同学稀释浓硫酸操作的示意图,正确的是 (填"A"或"B").

(4)玻璃棒搅拌的作用是 .
小红同学进行酸碱中和反应的实验(如图所示)。她向氢氧化钠溶液中滴加一定量稀盐酸后,想起氢氧化钠溶液中事先没有滴加指示剂,为了确定盐酸与氢氧化钠的反应程度,她从烧杯中取了少量溶液于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到试管中溶液颜色没有变化。于是她对烧杯中的溶液进行了以下探究:
(1)小红认为此时烧杯中的溶液可能有以下三种情况:
①盐酸与氢氧化钠恰好完全反应;②氢氧化钠有剩余;③盐酸过量。
小明同学却断定不可能"氢氧化钠有剩余",他的理由是: ;
(2)他们共同设计了一个实验方案,欲对上述其他两种可能情况进行验证。请根据相关内容填写如表:
|
试验方法 |
可能观察到的现象 |
结论 |
|
将少量锌粒放入试管中,然后从烧杯中取适量溶液至试管中。 |
如果 |
则盐酸过量 |
|
如果 |
则盐酸与氢氧化钠恰好完全反应 |
(3)经过讨论,他们认为利用下列几种物质代替锌粒,也可以达到验证目的。你认为其中不正确的是 (填序号)。
A.生锈的铁钉 B.碳酸钠粉末 C.硫酸钠粉末 D.氢氧化铜
(4)如图曲线能够表示小红所做试验中溶液pH变化趋势的是 (填序号)。


有一包白色固体样品,可能由硫酸钠、氢氧化钠、碳酸钙、氯化钡、氯化镁中的一种或几种物质组成,为探究该样品的组成,某小组取适量样品按下列流程进行实验。
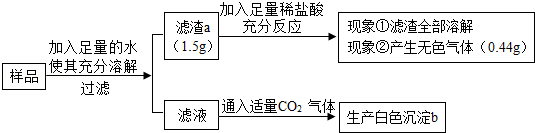
请回答下列问题:
(1)过滤操作中用到的玻璃仪器有烧杯、玻璃棒和 ,其中玻璃棒的作用是 。
(2)滤渣a的成分是 ,滤液中溶质的成分除氯化钠还有 ,白色沉淀b的成份是 。
(3)若现象①"滤渣全部溶解"变为"滤渣部分溶解",其他现象不变,则原样品中不能确定是否存在的物质是 。