我国海水晒盐的历史悠久。学习小组对粗盐进行提纯,并利用氯化钠进行实验探究。
Ⅰ.粗盐的提纯
粗盐中含有不溶性泥沙、可溶性CaCl2、MgCl2等杂质。学习小组设计了如下方案提纯粗盐: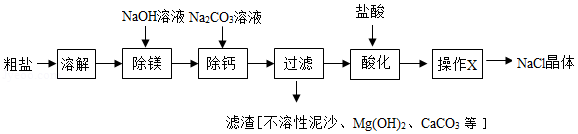
(1)用化学方程式表示Na2CO3溶液的作用: 。
(2)“过滤”中玻璃棒的作用为 ;“操作X”的名称为 。
Ⅱ.探究氨盐水与二氧化碳的反应
步骤1 取50mL浓氨水于锥形瓶中,加入NaCl晶体至不再溶解,制得氨盐水。
步骤2 向烧瓶中加入20mL氨盐水和约16g干冰,塞紧瓶盖,振荡、静置。一段时间后溶液中析出细小晶体,过滤、用冷水洗涤晶体并低温干燥。
【提出问题】晶体的成分是什么?
【实验探究1】①经甲同学检验,晶体中不含铵盐。甲同学的实验操作及现象是 。
②乙同学取晶体少许,加入稀硝酸,晶体溶解并产生无色气体,再滴加几滴AgNO3溶液,未见明显现象,说明晶体中不含有 离子。
【提出猜想】晶体的成分为Na2CO3或NaHCO3或两者的混合物。
【查阅资料】Na2CO3受热不分解;
NaHCO3受热易分解:2NaHCO3 Na2CO3+H2O+CO2↑。
【实验探究2】称取m1 g晶体,利用如图装置(夹持仪器略)探究晶体的成分。
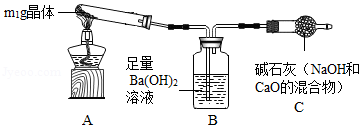
【实验现象】反应一段时间后,试管口凝结了少量小液滴,Ba(OH)2溶液变浑浊。
【实验分析】①晶体中一定含有 (填化学式)。
②将晶体加热至残留固体的质量不再改变,测得残留固体的质量为m2 g.若m1:m2= ,说明晶体为NaHCO3。
【拓展延伸】①氨盐水与二氧化碳反应所得铵盐的用途为 。
②丙同学认为通过测定装置B中沉淀的质量,经计算分析也可确定晶体的组成。请对丙同学的观点进行评价: 。
请用氧气、氯化钠、甲烷、氧化钙四种物质的化学式填空:
(1)供给生物呼吸的是 . (2)用作燃料的是 .
(3)用作干燥剂的是 . (4)用于配制生理盐水的是 .
某化学兴趣小组在实验室用硫酸铜溶液和氯化钡溶液反应制取少量氯化铜溶液,他们的实验过程和相关数据如下(BaSO4不溶于水)
第一步:称得烧杯的质量是100g。
第二步:反应前称得烧杯,氯化钡溶液及硫酸铜溶液的总质量是346.6g。
第三步:两者恰好完全反应后,过滤,称得烧杯及滤液的总质量是300g
请计算:(1)反应后生成沉淀的质量是 。
(2)所得氯化铜溶液中溶质的质量分数(写出计算过程,精确到0.1%)
工业上常用红锌矿(主要含ZnO)和18﹣25%的稀硫酸为原料制取硫酸锌.
(1)硫酸锌中硫元素和氧元素的质量比是 .
(2)100g溶质质量分数为98%的浓硫酸配制成溶质质量分数为20%的稀硫酸,需要水的质量是 g.
某化学课堂围绕“酸碱中和反应”,将学生分成若干小组开展探究活动。请你和他们一起完成以下稀盐酸和氢氧化钙发生的中和反应实验探究。
[演示实验]将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中。该反应的化学方程式是 ;
[查阅资料]CaCl2溶液显中性,
CaCl2+Na2CO3═CaCO3↓+2NaCl
[提出问题]实验中未观察到明显现象,部分同学产生了疑问:
反应后溶液中溶质的成分是什么?
[猜想与假设]针对疑问,甲组同学猜想如下:
猜想Ⅰ:只有CaCl2
猜想Ⅱ:有
猜想Ⅲ:有CaC12和Ca(OH)2
猜想Ⅳ:有CaCl2、HCl和Ca(OH)2
乙组同学对以上猜想提出质疑,认为猜想Ⅳ不合理,其理由是 ;
[实验探究]为了验证其余猜想,各小组进行了下列三个方案的探究。
|
实验方案 |
滴加紫色石蕊试液 |
通入CO2 |
滴加Na2CO3溶液 |
|
实验操作 |
|
|
|
|
实验现象 |
产生白色沉淀 |
||
|
实验结论 |
溶液中含有Ca(OH)2 |
溶液中含有Ca(OH)2 |
溶液中含有Ca(OH)2 |
[得出结论]通过探究,全班同学一致确定猜想Ⅲ是正确的。
[评价反思](1)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因 ;
(2)在分析反应后所得溶液中溶质的成分时,除了考虑生成物外,还需要考虑 。
根据下图回答问题。

(1)实验室用高锰酸钾制取氧气,选用的发生装置是 (填序号)。
(2)实验室里用装置A制取二氧化碳,其反应的化学方程式是 、 。
(3)用装置D收集氧气,下列实验操作不正确的是 、 (填序号)。
a.加热前,将集气瓶装满水,用玻璃片盖住瓶口,倒立在盛水的水槽中。
b.加热后,观察到水中导管口开始有气泡时,立即收集气体
c.待集气瓶里的水排完后,在水面下用玻璃片盖住瓶口,移出水槽正放在桌面上。