黄铜是铜和锌的合金。某化学兴趣小组的同学欲测定实验室中某黄铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程。称量10g粉末状黄铜样品放入烧杯中,量取45mL稀硫酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如表:
第一次 |
第二次 |
第三次 |
|
加入稀硫酸的体积(mL) |
15 |
15 |
15 |
生成氢气的质量(g) |
m |
0.04 |
0.02 |
试求:
(1)m的数值 。
(2)此黄铜样品中铜的质量分数是少?(写出计算过程)
蛋白质是由丙氨酸(C3H7NO2) 等多种氨基酸构成的。根据丙氨酸的化学式计算:
(1)丙氨酸由 种元素组成(写数值);
(2)一个丙氨酸分子中含有 个原子;
(3)丙氨酸的相对分子质量为 ;
(4)丙氨酸中氮、氢元素的质量比为 (写最简比)。
酸、碱、盐在生产生活中具有广泛的用途。
(1)化学实验室有失去标签的稀硫酸、氢氧化钠、氢氧化钙、碳酸钠、氯化钡五瓶无色溶液,现将其任意编号:A、B、C、D、E,然后两两组合进行实验,其部分现象如表(微溶物视为可溶物):
|
实验 |
A+B |
A+C |
A+D |
B+C |
|
现象 |
产生气体 |
产生沉淀 |
产生沉淀 |
产生沉淀 |
①写出溶液B、C中溶质的化学式:B ,C 。
②写出溶液A与D反应的化学方程式 。
(2)我国制碱工业先驱侯德榜发明了“侯氏制碱法”,其主要化学原理:
NaCl+H2O+NH3+CO2=NaHCO3↓+X;
2NaHCO3 Na2CO3+H2O+CO2↑等。
Na2CO3+H2O+CO2↑等。
回答下列问题:
①X的化学式为 。
②将碳酸钠和碳酸氢钠的混合物l0g充分加热至质量不再改变,冷却,称量剩余固体质量为6.9g,则原混合物中碳酸钠和碳酸氢钠的质量比为 (写最简比)。
金属材料广泛应用于生产生活中。
(1)常温下大多数金属都是固体,但体温计中的金属却是液体,该金属是 。
(2)铝在空气中与氧气反应,其表面生成一层致密的氧化物薄膜,从而阻止铝进一步氧化。这种氧化物的化学式为 。
(3)向含有氯化铜、氯化锌、稀盐酸的混合溶液中加入过量铁粉,充分反应后过滤,滤液中含有的溶质是 (写化学式)。
(4)铁矿石有多种,如赤铁矿(主要成分Fe2O3)和磁铁矿(主要成分Fe3O4)等。
①写出赤铁矿石中的主要成分与一氧化碳反应的化学方程式 。
② 冶炼2900t含四氧化三铁80%的磁铁矿石, 理论上能得到含杂质2%的生铁的质量是 t(结果精确到0.1)。
(5)含有锌粉6.5g、铁粉5.6g、铜粉3.2g、铝粉1.8g的混合物与一定质量的稀硫酸充分反应,反应停止后,有6g固体剩余。则生成氢气的质量为 g。
根据下列装置图回答题:

(1)写出仪器a和b的名称:a ,b 。
(2)实验室用大理石和稀盐酸制取并收集二氧化碳,应选用的装置为 (填字母),若用F装置干燥二氧化碳气体,F中应加入的试剂是 。
(3)实验室用高锰酸钾制取氧气,该反应的化学方程式为 。
(4)实验室取用药品要注意节约,如果没有说明用量,一般应该取用最少量,固体药品只需盖满试管底部,液体药品取用 mL。
溶液与人们的生产生活密切相关。
(1)将少量下列物质分别放入水中,充分搅拌,可以得到无色溶液的是 (填字母)
A.高锰酸钾 B.汽油 C.面粉 D.白糖
(2) 在盛有水的烧杯中加入以下某种物质, 形成溶液过程中,温度没有明显变化的是 (填字母)。
A.烧碱 B.硝酸铵 C.氯化钠 D.浓硫酸
(3)如图1为甲、乙两种固体物质的溶解度曲线。
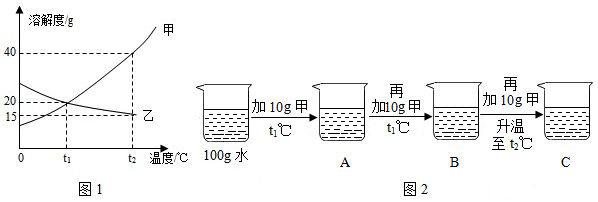
①溶解度随温度升高而增大的物质是 (填“甲”或“乙”)。
②某同学按图2所示进行实验,得到相应温度下的A、B、C溶液,在A、B、C三种溶液中属于饱和溶液的是 (填字母)。 向溶液C中再加入25g甲,充分搅拌,恢复到t2℃时,所得溶液中溶质的质量分数为 (结果精确到0.1%)。
③ 将t2℃时的 甲、 乙两种物质的饱和溶液降温至t1℃, 所得溶液中溶质的质量分数甲 乙 (填“<”、“=”或“>“)。