化学使人类能够物尽其用,如图是石油综合利用的示意图。

(1)将石油加热炼制,利用石油中各成分的 不同,将它们分离可得到不同产品。
(2)城镇家庭经常用罐装液化石油气做燃料,烹调食物时观察到燃气灶的火焰呈现黄色,锅底出现黑色,需要将灶具的进风口调大,目的是 。烹调结束,关闭燃气灶阀门利用的灭火原理是 。
(3)在汽油中加入适量乙醇作为汽车燃料,可适当节省石油资源,并在一定程度上减少汽车尾气的污染。写出乙醇充分燃烧的化学方程式 。
Na2CO3和NaHCO3有很多相似的化学性质,例如它们都能与稀盐酸反应生成 气体。某学习小组对它们的鉴别方法产生了探究兴趣。
【提出问题】如何鉴别Na2CO3和NaHCO3呢?
【查阅资料】(1)NaHCO3固体受热分解生成碳酸钠和两种氧化物。
(2)Ca(HCO3)2可溶于水。
(3)通常状况下,NaHCO3是一种白色晶体,溶解度小于Na2CO3的溶解度,饱和的Na2CO3溶液中通入CO2气体,可生成NaHCO3。
【作出猜想】猜想一:可用酚酞溶液鉴别Na2CO3和NaHCO3溶液。
猜想二:可用加热的方法鉴别Na2CO3和NaHCO3固体。
猜想三:可用澄清石灰水鉴别Na2CO3和NaHCO3溶液。
猜想四:可用CO2气体鉴别Na2CO3和NaHCO3溶液。
小组同学一致认为猜想一不正确,理由是 。
【实验探究】请你与小组同学一起探究。
|
实验操作 |
实验现象 |
实验结论 |
|
|
实验1 |
分别取少量的Na2CO3和NaHCO3 固体于试管中加热,并将产生的气体通入澄清石灰水 |
加热Na2CO3时,澄清石灰水无变化;加热NaHCO3时,澄清石灰水变浑浊 |
|
|
实验2 |
分别取少量Na2CO3和NaHCO3溶液于试管中,加入澄清石灰水 |
两支试管中均产生了白色沉淀 |
猜想三 不正确 |
|
实验3 |
往盛有饱和Na2CO3和NaHCO3溶液的两支试管中分别通入足量的CO2气体 |
观察到 |
猜想四 正确 |
【问题讨论】
同学们对实验2的实验现象进行分析。从物质在溶液中解离出不同离子的微观角度分析,Na2CO3溶液与澄清石灰水发生反应的本质原因是 ,该反应的基本类型是 。石灰水与NaHCO3溶液也能反应生成白色沉淀,老师指出其反应原理较复杂,有待于今后学习中进一步探究。
【拓展应用】
除去固体Na2CO3中混有的少量NaHCO3,可用的方法是 (用化学方程式表示)。
某学习小组用图中的仪器或装置制备气体,请回答有关问题:

(1)请写出图中标有序号仪器的名称:① ; ② 。
(2)实验室用高锰酸钾制取氧气的化学方程式为 ,其发生装置可选择 (填序号)进行组装。组装仪器时,将玻璃管插入胶皮管前,先把玻璃管口 ,然后稍稍用力即可把玻璃管插入胶皮管内。
(3)若用E装置收集二氧化碳,验满方法是 。
(4)实验室若用块状固体和液体无需加热制取气体,发生装置可用D或F(有孔塑料板用来放块状固体)。和D相比,F装置的优点是 。
有一包固体X,可能由NH4NO3、FeCl3、NaOH、Na2SO4、CaCO3、Ba(NO3)2中的两种或两种以上物质组成。为探究其成分,进行如下实验:
(1)取少量固体X与熟石灰研磨,无氨味。则原固体中一定不含 。
(2)另取少量固体X按图中的甲进行实验。
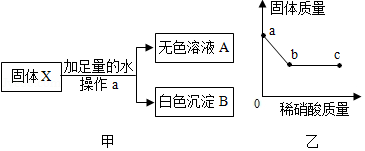
①操作a的名称是 ,由甲实验判断,原固体中一定不含 。
②取白色沉淀B于烧杯中并逐滴加入稀硝酸,烧杯中固体质量随滴入稀硝酸质量的变化如图乙所示。则白色沉淀B的成分为 ,图乙中c点时烧杯中的溶液一定含有的阳离子是 。
(3)为进一步探究原固体X的组成,取无色溶液A,向其中通入CO2气体,产生白色沉淀,由此判断固体X中还含有 。
2015年10月,我国科学家屠呦呦获得诺贝尔生理学或医学奖,她发现用于治疗疟疾的药物﹣﹣青蒿素(C 15H 22O 5)。青蒿素是一种无色针状晶体,味苦,几乎不溶于水,可溶于乙醇、乙醚,它对热不稳定,容易受湿、热和还原性物质的影响而分解。请结合短文的信息及所学的化学知识,回答下列问题:
(1)从含不含碳元素的角度分析,青蒿素和乙醇都属于 。
(2)请写出青蒿素的一种物理性质 。青蒿素药品应该 保存。
(3)乙醇俗称 ,是一种常用溶剂,还可用作酒精灯、内燃机的燃料,请写出其燃烧的化学方程式 。
课堂上,老师取20g蔗糖放入小烧杯中,加少量水使它润湿,注入10mL浓硫酸,搅拌,同学们看到蔗糖先变黑后“发酵”形成“黑面包”,同时还闻到了刺激性气味,同学们判断黑色固体是碳,原因是浓硫酸具有强 .
形成“黑面包”的主要原因是什么?在老师的指导下,同学们开展了探究活动.
【猜想与假设】浓硫酸与碳反应,生成大量气体使黑色固体膨胀.
【查阅资料】
Ⅰ.浓硫酸与碳在加热条件下反应,生成物中有SO2、CO2两种气体.
Ⅱ.SO2是一种具有刺激性气味的气体,能与Ca(OH)2溶液反应生成白色沉淀.
Ⅲ.SO2能使品红溶液褪色,而CO2不能.
【实验探究】
为验证碳与浓硫酸在加热条件下生成的气体产物,同学们在老师指导下设计并进行如图实验:
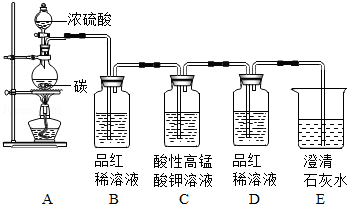
【事实与结论】
(1)请将能得出对应结论的实验现象填入表中.
|
验证气体 |
实验现象 |
实验结论 |
|
SO2 |
|
有SO2产生 |
|
CO2 |
|
有CO2产生 |
(2)碳与浓硫酸反应的化学方程式是 .
(3)浓硫酸与碳在加热条件下产生大量的SO2和CO2,使黑色固体膨胀,形成“黑面包”,猜想成立.
【反思与交流】
(1)小明同学提出,因老师的演示实验没有进行加热,所以同学们的探究实验无意义,其他同学一致否定了他的说法,理由是 .
(2)若B、E中试剂交换, (填“能”或“不能”)得出有CO2产生的结论,理由是 .
(3)C中酸性高锰酸钾溶液的作用是 .