化学是一门实用的基础科学,在人类社会的发展历程中起着重要作用。
正确认识物质
人们在实验研究中总结出常见金属的活动性顺序:

(1)请在表中□内填写对应的元素符号。
(2)Mg、Sn、Pt、Au四种金属,能与稀盐酸(或稀硫酸)发生置换反应的金属有 种。
(3)Cu能从AgNO3溶液中置换出Ag,请说明理由: 。
合理利用资源
(1)工业上用含氧化铁480t的赤铁矿为原料炼铁,得到含杂质4%的生铁 t。
(2)化学小组通过实验将生锈铁钉回收处理。
[铁钉处理]
实验过程 |
实验现象 |
实验原理 |
保存方法 |
a.向盛有生锈铁钉的烧杯中加入稀盐酸,浸没铁钉 |
溶液由无色变为黄色、铁钉表面有气泡产生、铁锈脱落 |
请写出稀盐酸除铁锈的化学方程式:
|
写出一条防止铁制品生锈的方法:
|
b.取出铁钉,洗涤、干燥,妥善保管 |
铁钉呈现银白色 |
(3)小组同学提出,烧杯中的废液也可以回收处理。
[废液处理]
同学们查阅相关资料,获知:
a.Fe2O3是一种红棕色粉末,俗称铁红,常用作红色油漆和涂料。
b.FeCl2+2NaOH=Fe(OH)2↓+2NaCl
c.4Fe(OH)2+O2+2H2O=4Fe(OH)3
d.不溶性碱受热易分解,生成对应的金属氧化物和水。
实验流程:
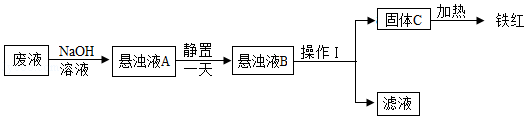
①悬浊液A静置一天的原因是 。
②操作I是 。
③写出固体C转化为铁红的化学方程式 。
促进科技发展
化学学科在合成药物等方面发挥若巨大作用,以下是几种常见的合成药物,请根据信息回答下列问题:
(1)解热镇痛药
阿司匹林是人们熟知的治感冒药,具有解热镇痛作用,化学式为C9H8O4,相对分子质量是 。
(2)抗生素
青霉素是最重要的抗生素,即消炎药,能治疗肺炎和外伤感染等。青霉素中用得较多的是青霉素钠,化学式为C16H17O4N2SNa,其中氢、氧元素质量比为 。
(3)抗酸药
抗酸药是一类治疗胃痛的药物,能中和胃里过多的盐酸,缓解胃部不适。抗酸药的种类很多,通常含有一种或几种化学物质,如NaHCO3、MgCO3、Mg(OH)2等。请写出其中一个与盐酸反应的化学方程式 。
碳及其氧化物性质的应用。
(1)如图所示,向盛有红棕色二氧化氮气体的集气瓶里投入几小块烘烤过的木炭,红棕色消失,说明木炭具有 能力,其原因是木炭具有 的结构。
(2)在书写具有保存价值的档案时,规定应使用碳素墨水,原因是 。
(3)将一定质量的金刚石在足量的氧气中充分燃烧,固体全部消失,写出反应的化学方程式 ;将生成的产物用足量的氢氧化钠溶液来充分吸收并测定其质量,当金刚石的质量恰好等于 时,则可证明金刚石是由碳元素组成的单质。
(4)在实验室里,检验二氧化碳一般用澄清石灰水,而吸收二氧化碳常用氢氧化钠溶液,理由是 。
(5)写出碳在高温时还原氧化铜的化学方程式,并计算要使80g氧化铜完全还原,需要碳的质量至少是多少?(在答题卡上写出计算过程)

水是由氢、氧两种元素组成的化合物。这一结论是科学家们在大量实险的基础上得出的。
(1)实验室中常用锌粒和稀硫酸反应来制备氢气。请从图1装置中选择并组装一套制取干燥氢气的装置,正确的连接顺序为 (用接口处字母填写)。
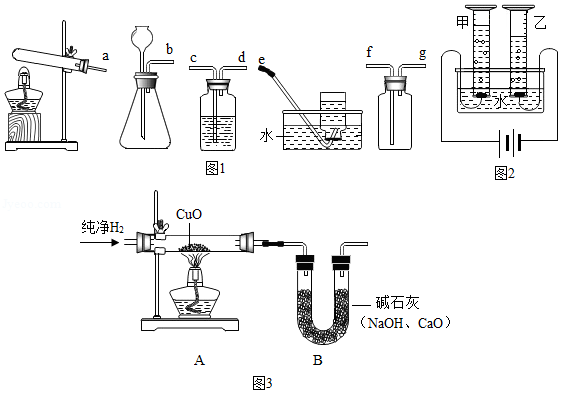
(2)研究氢气的燃烧实验是人们认识水组成的开始。
①氢气在点燃前一定要 。
②氢气在空气中燃烧时,若在火焰上方罩一冷而干燥的小烧杯,可观察到的现象是 。在相同条件下,欲使1L氢气完全燃烧,所需空气至少约为 L。
(3)科学家们又用“电解法”证明了水的组成(装置如图2所示,电极不与水及生成的气体反应)。电解时,水中需加入少量的NaOH,其作用是 。 通电一段时间后,发现甲、乙两量筒中收集的气体体积比略小于1:2,其原因可能是 (写出一条即可)。
(4)拉瓦锡还用另一实验证明了水的组成。
他让水蒸气通过一根烧红的铁质枪管,结果得到了氢气,同时枪管表面有黑色固体(磁铁矿的主要成分)生成。该反应的化学方程式为 。
(5)用“氢气还原氧化铜”实验也可以证明水的组成(图3)。装置A中的玻璃管和其中物质在反应前后的质量差为m1,装置B和其中物质在反应前后的质量差为m2,据此可计算出水中O、H元素的质量比为 (用含 m1、m2的代数式表示)。实验时该比值往往略小于8:1,原因可能是 (写出一条即可)。
(6)碘与锌在常温下反应速度很慢,若滴入几滴水则反应剧烈,水在此的作用是 。
对销售的化肥,国家有明确的质量要求。某兴趣小组对市售的某钾肥进行了检测,称取2.0g样品放入烧杯中,加入适量的水溶解后,逐滴加入10%的BaCl2溶液,产生沉淀的质量与所加入BaCl2溶液质量的关系如图1所示(假定杂质不参加反应)。
已知:K2SO4+BaCl2═BaSO4↓+2KC1。

(1)20.8g BaCl2溶液中所含溶质的质量为 g。
(2)通过计算,判断该钾肥中K2SO4的质量分数是否符合图2的包装说明?(写出计算过程)
水垢是日常生活中常见的物质,某兴趣小组收集了一部分水垢[主要成分CaCO3和Mg(OH)2,不考虑其他成分对实验的影响]并对其进行实验探究。
[查阅资料]①Mg(OH)2受热易分解,生成MgO和H2O;
②无水硫酸铜是白色固体,遇水变蓝色。
[探究活动一]验证水垢中的CaCO3和Mg(OH)2
(1)小斌取一定量水垢样品,高温灼烧,将生成的气体依次通过澄清石灰水和无水硫酸铜,观察到澄清石灰水变浑浊、无水硫酸铜变 色。
得出结论:水垢中含CaCO3和Mg(OH)2。
(2)小红提出小斌的实验方案存在明显缺陷,小红的理由是 。
[探究活动二]分离水垢中的CaCO3和Mg(OH)2
小林设计了如下实验流程(部分产物已略去):

(1)过滤用到的玻璃仪器有烧杯、玻璃棒和 。
(2)滤液A中的溶质有 (用化学式表示)。
(3)加入MgCl2溶液时,发生反应的化学方程式是 。
(4)操作II的实验步骤是 。
某课外活动小组进行如下实验探究。

(1)验证物质的燃烧条件
根据图1进行实验,实验现象如图所示。
①80℃热水的作用是 。
②比较现象a、c,得出燃烧的条件是 。
(2)验证锌与铁的金属活动性
①相同条件下,取等质量锌粉、铁粉,根据图2进行实验,实验过程中,观察到锌粉表面产生气泡的速率比铁粉快,由此得到的结论是 。
②实验结束后,发现∪形管两边的金属粉末均无剩余,则硫酸剩余的情况可能是 (填序号)。
A.左、右两边均有剩余 B.左边有剩余,右边无剩余
C.左、右两边均无剩余 D.左边无剩余,右边有剩余
(3)测定水中氢、氧元素的质量比(已知:H2+CuO Cu+H2O)
Cu+H2O)
根据图3进行实验,反应后测得甲中玻璃管(含药品)质量减少ag,乙中U形管(含药品)质量增加bg。

①水中氢、氧元素的质量比是 (用含 a、b的式子表示)。
②下列因素中,对测定结果有影响的是 (填序号)。
A.CuO粉末不干燥 B.CuO没有完全转化为Cu C.没有丙装置