某化学课外兴趣小组欲配制80g质量分数为12%的氢氧化钠溶液来制作“叶脉书签”。
(1)需要氢氧化钠固体的质量为 g。
(2)称量时,氢氧化钠固体应放在 (填“滤纸”或“烧杯”)中。
(3)下列说法或操作正确的是 (填字母序号)。
A、配制该溶液时所需的玻璃仪器中不包括玻璃棒
B、用量程为100mL的量筒量取所需要的水
C、将称量好的固体倒入装有水的量筒中溶解
(4)在量取水的体积时,若采用仰视的方法读数,则所配制的氢氧化钠溶液中溶质的质量分数将 (填“偏大”或“偏小”)。
(5)某同学用蒸馏水润湿了的pH试纸来测定配制好的溶液的pH值时,他测得的结果会 (填“偏大”、偏小”或“不变”)。
(6)该兴趣小组的同学提出还可以用配制好的氢氧化钠溶液和稀盐酸进行中和反应实验,具体操作如图:

在烧杯中加入10mL的氢氧化钠溶液,滴入几滴酚酞溶液,此时溶液呈 色。接着加入一定量的稀盐酸,用玻璃棒搅拌后发现溶液为无色,此时 (填“能”或“不能”)得出两者恰好中和的结论。以下操作及实验现象能证明加入的盐酸为过量的是 (填字母序号)。
A、加入少量铁粉,无明显现象
B、滴加紫色石蕊溶液,搅拌后溶液变蓝
C、加入碳酸钠溶液,产生气泡
绿矾(FeSO4•7H2O)是硫酸法生产太白粉的主要副产物,可用于制备Fe2O3,复印用Fe3O4粉、还原铁粉等,开发利用绿矾工艺是一项十分有意义的工作。某研究性小组展开了系列研究。
Ⅰ制备Fe2O3
【资料一】
(1)无水硫酸铜遇水变成蓝色的硫酸铜晶体。
(2)绿矾(FeSO4•7H2O)高温分解产生一种金属氧化物和几种气态非金属氧化物。
(3)SO2是无色有窒息性臭味的有毒气体,能使品红溶液褪色。
甲同学用如下装置制备Fe2O3并验证绿矾受热分解的其他产物;

实验过程中发现:A中有 色固体生成,B中无水硫酸铜变蓝,C中U形管内有无色晶体(SO3)析出,D中品红溶液褪色,装置E的作用是 ,绿矾高温分解的化学方程式为 。
Ⅱ制备Fe3O4
乙同学模拟生产复印用Fe3O4粉的实验流程如下:

【资料二】Fe(OH)2是一种白色难溶于水的固体,在空气中易被氧化。
FeSO4溶液中加入NaOH溶液,反应的化学方程式依次为① ,②4Fe(OH)2+O2+2H2O═4Fe(OH)3.由沉淀a获得Fe3O4的化学方程式为:Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O
若制取Fe(OH)2,采取的实验操作是:向盛有5mL新制FeSO4溶液的试管中加入10滴植物油,然后用胶头滴管加煮沸的NaOH溶液(驱赶O2),胶头滴管的正确使用方法是 (填字母)。

Ⅲ制备还原铁粉
制备还原铁粉的工业流程如下:

(1)操作1的名称是 ,NH4HCO3和FeSO4溶液反应的化学方程式为 。
(2)若将14.06g粗还原铁粉(假设粗还原铁粉中杂质仅含少量FexC)在氧气流中完全反应,得到0.22gCO2,将相同质量的粗还原铁粉与足量稀硫酸反应,得到0.48gH2(FexC与稀硫酸反应不产生H2)。试通过计算确定FexC的化学式(请写出计算过程) 。
(3)粗还原铁粉经加工处理后变成纯还原铁粉,纯还原铁粉和水蒸气在高温条件下也可制得四氧化三铁,同时生成一种气体。其装置如图所示:

SAP材料吸水性强,湿润的SAP材料能为该反应持续提供水蒸气。实验开始一段时间后,观察到在肥皂液中有大量的气泡产生,此气泡用火柴即能点燃,同时有肥皂泡飘到空中。生成的气体是 ,干燥的SAP材料作用是 。
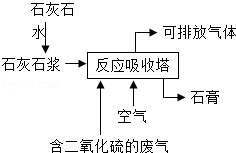
工业用石灰石浆吸收废气中的二氧化硫,并制取石膏(主要成分为硫酸钙).简易流程如图,主要的反应为:2CaCO 3+2SO 2+O 2═2CaSO 4+2X
(1)流程中石灰石加水制成石灰石浆的目的是 .反应中X的化学式为 ,硫元素的化合价在反应前后的变化为 .
(2)减少二氧化硫的排放,主要为了 (填序号)
A、减缓温室效应 B、减少酸雨形成 C、防止破坏臭氧层
(3)按上述方法处理2000吨废气中的SO 2,至少需要含5吨碳酸钙的石灰石浆.求:废气中SO 2的质量分数.
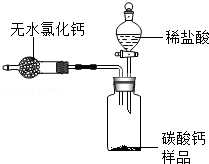
为测定某市售碳酸钙药品中碳酸钙的质量分数(杂质为SiO2,与稀盐酸不反应),某同学的方法是:将样品与稀盐酸反应,测定反应后生成的CO2质量,再根据CO2的质量求出样品中碳酸钙的质量,从而计算出样品中碳酸钙的质量分数.为测定生成CO2的质量,他设计了如下实验方案(已知:无水氯化钙是常见的干燥剂):
(1)按图组装好装置,检查装置气密性后,在分液漏斗中加入过量稀盐酸,并在干燥管中加入适量无水氯化钙样品,称得装置和药品的总质量为564.57g;
(2)在广口瓶中加入碳酸钙样品,称得装置和药品的总质量为574.57g;
(3)旋紧橡皮塞,打开分液漏斗旋塞,向广口瓶中滴加稀盐酸,使样品与稀盐酸完全反应;
(4)反应结束后,称得装置及装置内所有物质的总质量为570.57g
请根据上述实验回答下列问题:
(1)该方案测得样品中碳酸钙的质量分数是多少(写出解题过程,计算结果精确到0.1%)?
(2)该实验中用稀盐酸与碳酸钙样品反应,而不用浓盐酸与碳酸钙样品反应,其原因是 .若实验中不用无水氯化钙干燥,则测得样品中碳酸钙的质量分数与上述实验计算结果相比 (选填“偏小”或“不变”或“偏大”).
某同学取用生石灰时,发现装满生石灰的塑料试剂瓶已经膨胀破裂,如图:
(1)塑料试剂瓶膨胀破裂的原因是 ,反应的化学方程式为 .
(2)破裂后瓶内试剂会吸收空气中CO2生成CaCO3.为测定其中CaCO3的质量分数,兴取小组分别进行如下实验:
实验1:称取10.0g样品,加50.0g水溶解,搅拌、静置、过滤,将沉淀洗涤、干燥、称重.
实验2:称取10.0g样品,向其中加入足量稀盐酸,充分反应,收集产生的气体.
①根据实验1称重计算样品中CaCO3的质量分数可能偏高,原因是 .
②若实验2中收集的气体为2.2g,计算样品中CaCO3的质量分数.(请写出计算过程)

空气中氧气含量测定的再认识。
【经典赏析】教材中介绍了拉瓦锡用定量的方法研究了空气的成分(实验装置如图1)。该实验中选择使用汞的优点有 。
A.实验过程中没有污染
B.在汞槽中起到液封作用
C.生成的化合物加热分解又能得到汞和氧气
D.能将密闭装置内空气中的氧气几乎耗尽
【实验回顾】实验室常用红磷燃烧的方法测定空气中氧气的含量(装置如图2),写出红磷燃烧的化学方程式 。兴趣小组用该方法测出的氧气含量常常远低于21%。
【提出问题】用红磷燃烧的方法为什么不能准确地测定空气中氧气的含量?
【进行猜想】(1)装置漏气;(2) 装置内氧气有剩余;…
【实验与交流】在老师的指导下,小明分别用过量的红磷和白磷进行该实验,用测氧气浓度的传感器测得反应后装置内氧气浓度分别为8.85%和3.21%,请从燃烧条件的角度回答产生上述结果的主要原因 。
【实验探究1】小明根据铁生锈的原理,探究用铁能否准确测定空气中氧气的含量,于是进行了实验(装置如图3)通过7天测得的数据计算空气中氧气的含量为19.13%。
【交流与反思】与用红磷燃烧的方法相比,用铁丝生锈的方法测定的主要优点及原因: 。
【实验探究2】为了加快反应速率,小明通过查阅资料,利用铁粉、炭粉、氯化钠等物质又进行了实验(装置如图4),8分钟后测得的数据如表:
|
实验前的体积 |
实验后的体积 |
|
|
集气瓶内空气 |
烧杯内蒸馏水 |
烧杯内剩余蒸馏水 |
|
131mL |
90.0mL |
63.6mL |
请计算出空气中氧气含量 (计算结果保留一位小数)
【结论与反思】通过上述实验探究,选择 (填物质名称)进行实验,可较为快速地完成实验并减小实验误差。
【拓展延伸】铜也能与空气中氧气、水、二氧化碳反应而锈蚀,生成铜绿[铜绿的主要成分为Cu 2(OH) 2CO 3],若将图3装置中的粗铁丝换成足量的铜丝进行实验,请判断能否比较准确地测定空气中氧气的含量,并说明理由。 。
