随着人类现代化程度迅速提高,温室气体(CO2)排放日益增加,为降低温室气体含量,科学家正在研究一种新型的“人造树叶”。假设每1升“人造树叶”每天可从空气中吸收二氧化碳880g并转化为乙醇(C2H5OH),对应化学方程式为2CO2+3H2O C2H5OH+3O2.请回答:
(1)写出该研究的一点意义 。
(2)若每天一棵树平均可吸收44g CO2,则一升“人造树叶”一天吸收的CO2相当于 棵树吸收的CO2。
(3)1升“人造树叶”工作一个月(按30天计)可得到乙醇多少克?(写出计算过程)。
根据如图,回答下列问题。
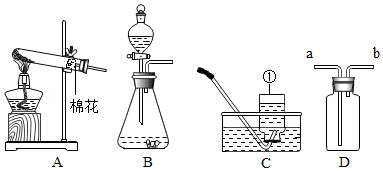
(1)图中标有序号①的仪器名称是 。
(2)实验空中高锰酸钾制取氧气,反应的化学方程式是 ,应选择的发生装置是 (填序号)。
(3)若用D装置收集氢气,则气体应从 填(“a”或“b”)端进入。
2016年11月,“冰箭”冲天,中国挺进大火箭时代。
(1)氢气的利用。火箭采用液氢、液氧作为推进剂,其内部温度极低,因此称为“冰箭”,氢气是 (填序号)。
a.常规能源 b.绿色能源 c.不可再生能源
22相比,其优点是
557,写出该反应的化学方程式 。
(4)氢燃料电池是将化学能直接转化为 ,且能量转化效率高达约80%;与化石燃料相比,氢能源的优点是:①原料来源广,②产物无污染,③ 。

氯化钠是重要的化工原料,氯碱工业生产的一种流程如图:

(1)从“海水→粗盐→精盐”的过程包括溶解、过滤、蒸发等实验操作,实验室中上述3种操作都需要使用的仪器是 (填名称)
22等物质,“精制”过程中加入NaOH的目的是 。
(3)写出“电解槽“中发生反应的化学方程式 ,流程中可以循环使用的物质有 (填化学式)
23和NaCl等杂质,用“离子交换膜法”生产的碱样品质量主要标准如下表所示
|
等级 |
氢氧化钠含量 |
碳酸钠含量 |
|
优等品 |
≥99.0% |
≤0.5% |
|
一等品 |
≥98.5% |
≤0.8% |
|
合格品 |
≥98.0% |
≤1.0% |
23的原因是 23,下列试剂中可选择使用的是
a.酚酞 b.稀盐酸c。澄清石灰水
②李老师设计和完成了如下实验来判断碱样品的等级。
3)固体0.197g;向滤液中加入几滴酚酞,再逐滴加入稀盐酸至恰好完全反应,共消耗溶质质量分数为5%的稀盐酸365g。该碱样品的等级是 (不考虑其他杂质参加反应)
铁的冶炼与利用是学习和研究化学的重要课题。
Ⅰ.铁的冶炼。竖炉炼铁的工艺流程如图1所示。
4燃烧的作用是
(2)写出“还原反应室”中炼铁的一个反应的化学方程式 。
422242的质量(m)范围是 。
323232的铜冶炼废水。在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中重金属离子的去除率,实验结果如图2所示。
2+2+2+不能被除去,其原因是 。
(2)铁炭混合物中铁的质量分数为0时,也能除去水中少量的重金属离子,其原因是 。
(3)处理效果最好时,铁炭混合物中的铁的质量分数为 。
研究小组同学对铝和稀盐酸的反应进行了探究。如图1所示实验,先检查装置气密性,再将橡皮塞连接气体压力传感器,烧瓶中放入铝片和稀盐酸,塞紧瓶塞并打开仪器,一段时间后,得到如图2所示的气体压强与时间的关系曲线图。
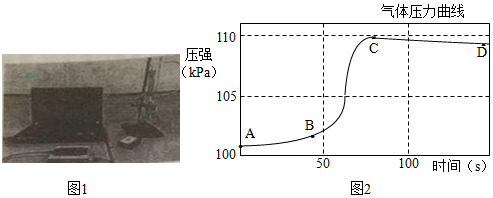
(1)铝与稀盐酸反应的化学方程式为 。
(2)AB段气体压力变化不明显的原因是 ;CD段气体压力逐渐下降的原因是 。
(3)从BC段看反应的速率是先变快后变慢,导致变慢的因素有 (填序号)
a.铝片的表面积
b.盐酸的浓度
c.温度