利用废弃的黄铜(含铜、锌)制取海绵铜(Cu),并得到硫酸锌溶液,主要流程如图(反应条件已略去):

已知:2Cu+2H2SO4+O2 2CuSO4+2H2O
(1)过程Ⅱ中加入过量锌粉的目的是 。
(2)过程Ⅲ中有气体产生,所选用的物质C是 (填一种酸)。
某实验小组将少量氢化钙(CaH2)溶于水,形成了无色透明的溶液,再向其中加入碳酸钠溶液,有沉淀产生,经过滤后得到滤渣和滤液。然后进行了滤渣验证和滤液溶质成分的探究。
(1)[查阅资料]氢化钙在常温下能与水反应生成氢氧化钙和氢气,写出该反应的化学方程式 。
(2)[交流验证]滤渣只能是碳酸钙,用盐酸验证此滤渣的化学方程式为 。
(3)[提出问题]滤液中溶质的成分是什么?
(4)[猜想假设]猜想一:NaOH
猜想二:NaOH和Na2CO3
猜想三:NaOH和
猜想四:NaOH、Na2CO3和Ca(OH)2
(5)[讨论分析]经过讨论认为最不合理的是猜想 ,原因是 。
(6)[实验与结论]
|
实验步骤 |
现象 |
结论 |
|
步骤Ⅰ:取少量滤液,向其中加入足量盐酸溶液 |
|
猜想二不成立 |
|
步骤Ⅱ:另取少量滤液,向其中滴入适量Na2CO3溶液 |
产生白色沉淀 |
猜想 成立 |
(7)[拓展延伸]在分析反应后所得物质的成分时,除考虑生成物外,还需考虑 。
根据下列实验装置图,回答有关问题。

(1)图中标有①的仪器名称为 。
(2)实验室用加热熟石灰与氯化铵固体的方法可以制取氨气,其发生装置选用 。(填大写字母)
(3)实验室用锌粒和稀硫酸制取H2的发生装置选用 (填大写字母),反应的化学方程式为 。
(4)实验室用双氧水和二氧化锰制取一瓶干燥的氧气,所选仪器的接口连接顺字是 (填导管接口的小写字母)。
某实验小组为测定铜和氧化铜的混合物中铜元素的含量,取20g该固体混合物,向其中逐滴加入稀H2SO4,测得剩余固体的质量与加入稀H2SO4的质量关系如图所示。回答下列问题:

(1)写出滴加稀H2SO4时发生反应的化学方程式 。
(2)该固体混合物中铜元素的质量为 。
(3)计算稀H2SO4中溶质的质量分数(写出计算过程)。
某“自加热食品”发热包的主要成分为生石灰、活性炭、铝粉、铁粉、碳酸钠和氯化钙,其使用说明如图1:
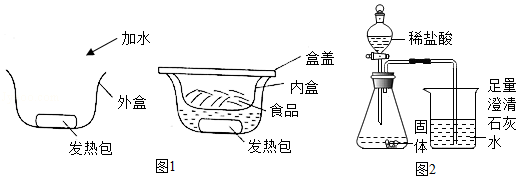
某化学兴趣小组对发热包进行了如下探究。
探究Ⅰ:发热包的发热原理
将发热包中固体倒入烧杯中,加入适量水,发生剧烈反应,水很快沸腾。反应结束后,烧杯底部有大量固体,继续加水搅拌,过滤、洗涤、干燥,得到固体混合物。
(1)发热包中的某成分与水反应放出大量的热,该反应的化学方程式是 。
探究Ⅱ:固体混合物的成分
查阅资料:单质铝既能与盐酸反应又能与氢氧化钠溶液反应,并产生H2。
小组同学认为固体混合物的成分可能是:活性炭、铝粉、铁粉、碳酸钙和氢氧化钙。为进一步探究其成分,小组同学设计并进行如下实验:
(2)取少量固体于试管中,加水振荡,静置,滴入几滴酚酞溶液,溶液变为红色,证明固体中含有 。
(3)另取少量固体于锥形瓶中,逐渐加入稀盐酸至不再产生气泡为止(如图2),反应停止后瓶底有黑色固体剩余,溶液呈浅绿色。
①反应停止后,瓶底的黑色固体为 ,判断依据是 。
②当观察到 现象,证明固体中含有CaCO3。
③证明固体中含有铁粉的现象是 。
(4)设计实验方案证明固体混合物中含有铝粉。(可供选择的试剂:CuCl2溶液、稀盐酸、NaOH溶液)
实验室按如图步骤配制100g质量分数为22%的蔗糖溶液。
 回答下列问题:
回答下列问题:
(1)所需蔗糖的质量为 。
(2)用规格为 (填“50”、“100”或“500”)mL的量筒量取 mL蒸馏水倒入盛有蔗糖的烧杯中进行溶解。(水的密度约为1g/cm3)
(3)溶解时玻璃棒的作用是 。
(4)下列情况会导致所配溶液中溶质的质量分数偏高的是 (填字母序号)。
A.蔗糖中混有少量杂质
B.称量时蔗糖和砝码位置放反了(使用了游码)
C.用于溶解蔗糖的烧杯洗净后残留有少量的水
D.用量筒量取水时,俯视读数