南通滨临长江,将长江水净化处理可成为居民生活用水。
(1)水净化时先加入絮凝剂,沉降过滤后,通过活性炭。活性炭的作用是 。
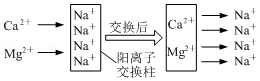
(2)将硬水通过如图所示的阳离子交换柱后可变成软水(图中阴离子未画出),交换后的水仍然呈电中性。
①一个Ca2+可以交换出 个Na+。
②阳离子交换柱长时间使用后,Na+变少,失去硬水软化功能而失效。利用生活中常见物质检验阳离子交换柱已失效的方法是 。
(3)二氧化氯(ClO2)可用于饮用水的杀菌消毒。取100mL经ClO2消毒后的饮用水于锥形瓶中,调节溶液至弱碱性,加入足量KI充分反应,测得生成I2的质量为0.0254mg。上述过程中发生的反应为2ClO2+2KI═2KClO2+I2,其他物质不参与反应。计算该饮用水中ClO2的残留量(以mg/L计),在答题卡上写出计算过程。
宏宏同学发现上个月做实验用的氢氧化钠溶液忘记了盖瓶盖。对于该溶液是否变质,宏宏邀约几个喜欢探究的同学对此进行了探究。请你一起完成下列实验报告。
(1)【提出问题1】
该溶液是否变质?
【实验探究1】
|
实验步骤 |
实验现象 |
解释与结论 |
|
取少量该溶液放于试管中,滴加足量稀盐酸 |
有 产生 |
说明该溶液已变质。变质的原因是 (请用化学方程式表示)。 |
(2)【提出问题2】
该溶液变质程度怎样?
【提出猜想】
猜想一:已完全变质,该溶液中溶质只含Na2CO3
猜想二:部分变质,该溶液中溶质含有 。
【查阅资料】
氯化钡溶液呈中性。
【实验探究2】
|
实验步骤 |
实验现象 |
结论 |
|
先取少量该溶液放于试管中,加入过量氯化钡溶液 |
有 生成 |
猜想 成立 |
|
静置,取上层清液于另一支试管中,加入2﹣3滴酚酞溶液 |
上层清液变红 |
(3)【提出问题3】
怎样提纯该样品得到纯净的氢氧化钠固体。
【实验探究3】
为得到纯净的氢氧化钠固体,同学们取该样品并设计了如图实验方案。
请回答下列问题:
①操作a和操作b中都需用到玻璃棒,其中操作a中玻璃棒的作用为 。
②根据实验流程可知,最终所得氢氧化钠固体质量 变质后样品中氢氧化钠的质量(填“大于”、“小于”或“等于”)。
(4)【反思交流】
在【实验探究2】中加入过量的氯化钡溶液的目的是什么? 。
学校化学兴趣小组欲利用下列装置进行相关实验探究,请你分析并填空。
(1)写出图中标号仪器名称② 。
(2)下列哪种方法可以得到平稳的氧气流? (填序号)
①把二氧化锰加入装有过氧化氢溶液的试管中
②把过氧化氢溶液缓缓加入盛有少量二氧化锰的试管中
(3)某同学利用同一套发生装置先后完成实验室制取二氧化碳和实验室制取氧气,他选择的发生装置是 (填字母代号),利用该装置制取氧气的化学方程式为 。
(4)实验室制取二氧化碳,常选用装置 (填字母代号)收集二氧化碳。收集时,将燃着的木条放在瓶口,观察到 ,说明瓶中已集满二氧化碳。
2019年6月7日(农历五月初五)是一年一度的传统佳节﹣端午节。我们衡阳地区过端午节有吃盐蛋、粽子、黄糖、肉包的习俗。从健康角度分析,除了水之外你认为还需要补充的食物是 (试举一例)。现在人们崇尚健康生活,请你就人们的健康生活提出一条合理化的建议 。
(1)衡阳被誉为“有色金属之乡”,金属材料使用极为广泛。保护金属资源的有效途径有(请列举出任意两点): 、 。
(2)2019年5月河南某市的“水氢动力汽车”成为新闻的热点,再度吸引人们对新能源开发应用的关注。氢气作为新能源,越来越受到人们的重视。
①氢气作为燃料与正在广泛使用的化石燃料相比,有什么优点? (任写一条)。
②你还能举出另一种新能源的例子吗? 。
2019 年 5 月湖南省第七届矿博会在郴州市隆重举行,展厅上展出了各种矿物,其中有一 枚黑色的陨石引起了大家的兴趣。查阅资料获知,陨石的主要成分是铁和铁的化合物。
(1)通常情况下碳粉和铁粉都是黑色,检验碳粉中是否含有铁粉既可用物理方法又可 用化学方法:
①物理方法是 ;
②化学方法是 。
(2)常见铁的氧化物有 FeO、Fe 2O 3、 。(填化学式)
(3)铁制品在潮湿的空气中易生锈,实际上是铁与空气中的氧气、 等发生化 学反应的过程,请举出一例防止铁制品锈蚀的方法 。
实验员小明取一小块陨石进行了研究,研究过程如图所示:

(4)图中操作 2的名称是 。
(5)溶液2中的溶质是 。(写化学式)
(6)陨石中含铁元素的质量分数为 。