钢铁的腐蚀是重要研究课题。
[知识回顾]用如图1所示实验进行铁钉腐蚀的研究。一段时间后试管A、B中铁钉几乎没有生锈,而试管C中铁钉明显锈蚀,试管D、E中铁钉严重锈蚀。
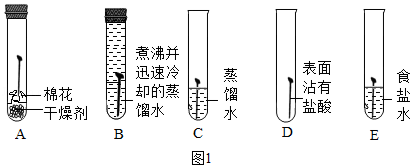
(1)由A、B、C的现象可知,铁的锈蚀是铁跟 (填化学式)等物质作用的过程。
(2)试管B中使用“煮沸并迅速冷却的蒸馏水”,其目的是 。
[实验探究]向试管D中(含生锈铁钉)加入过量10%稀盐酸,浸泡。可观察到铁锈逐渐消失,铁钉表面有气泡产生,溶液呈黄色,一段时间后黄色变为浅绿色。
(3)写出铁锈溶于盐酸的化学方程式: 。
(4)推测试管D中溶液由黄色变为浅绿色,可能是因为氯化铁与某些物质发生反应所致。现进行如表3个实验(持续10小时,已知氢气不影响该反应)
序号 |
实验Ⅰ |
实验Ⅱ |
实验Ⅲ |
实验内容 |
|
|
|
现象 |
溶液颜色始终呈黄色 |
产生红褐色沉淀 |
溶液逐渐由黄色变浅绿色 |
①设计实验Ⅰ的目的是 。
②综合分析上述3个实验,试管D中溶液由黄色变为浅绿色的原因是 。
[拓展延伸]研究水样的pH、水中溶解氧浓度与钢铁腐蚀速率的关系。查阅相关文献得到如下资料。
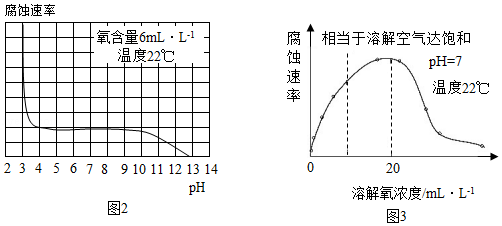
(5)图2表示水样温度22℃、氧含量6mL•L﹣1时,钢铁腐蚀速率与水样pH的关系。当pH<4时,钢铁腐蚀速率明显增大的原因是 。
(6)图3表示温度22℃、pH=7时,钢铁腐蚀速率与水中溶解氧浓度的关系。当溶解氧超过20mL•L﹣1时,钢铁腐蚀速率明显下降的原因可能是 。
根据图所示信息进行计算.
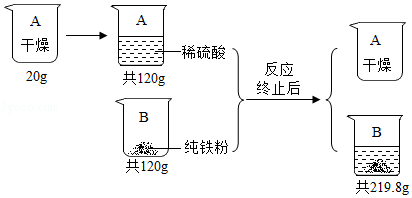
假设:稀硫酸转移完全且生成气体全部逸出.
(1)生成H2的质量为 g.
(2)反应后的溶液中溶质质量分数为多少?(写出解题过程,最后结果保留两位小数)
某化学兴趣小组欲测定一瓶过氧化氢溶液中溶质的质量分数,实验操作及相关数据如图所示:
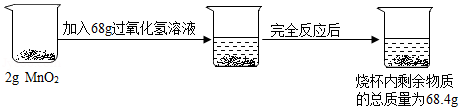
(1)生成氧气的质量 g
(2)这瓶过氧化氢溶液中溶质的质量分数是多少?(写出计算过程)
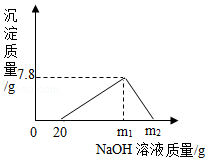
已知:Al(OH)3沉淀可溶于NaOH溶液,其反应方程式为:Al(OH)3+NaOH═NaAlO2+2H2O,现向100 g HCl和AlCl3的混合溶液中逐滴加入质量分数为20%的NaOH溶液,产生沉淀的质量与所加NaOH溶液的质量关系如图所示。回答下列问题:
(1)原混合溶液中HCl的质量分数是 。
(2)当沉淀达到最大值时生成NaCl的质量是多少?
(3)m2= 。
化学兴趣小组的同学发现实验台上有一瓶标签残缺的试剂(如图),同学们对此进行了如下探究。
【提出问题】这是一瓶什么溶液?
【猜想与假设】海天同学的猜想是Na2SO3溶液;刘浩同学的猜想是Na2SO4溶液;你的猜想是 (写一种)。
【查阅资料】
Ⅰ白色沉淀BaSO3不溶于水,但要溶于稀盐酸。
Ⅱ硝酸具有强氧化性,能将BaSO3氧化成BaSO4。
ⅢNa2SO3与稀盐酸反应产生SO2,SO2能使石灰水变浑浊,也能使品红溶液褪色。
【进行实验】
Ⅰ海天同学取适量的该溶液于试管中,滴加稀盐酸,产生无色气体,他认为自己的猜想成立,而刘浩同学认为他的结论不合理,原因是 。
Ⅱ刘浩同学为了验证自己的猜想,做了如下实验:
取适量的该溶液于试管中,先滴加足量的BaCl2溶液,再滴加过量稀硝酸,现象为 ,刘浩同学认为自己的猜想成立。
Ⅲ卓玛同学对刘浩同学的猜想又提出了质疑,她认为加BaCl2和稀硝酸,Na2SO3也会产生沉淀,为了验证自己的观点,做了如下实验:
|
步骤 |
操作 |
实验现象 |
实验结论 |
|
步骤1 |
取少量该溶液于试管中,滴加足量的BaCl2溶液 |
|
无 |
|
步骤2 |
向步骤1的试管中滴加足量的稀盐酸 |
|
此溶液不是Na2SO4 |
|
步骤3 |
将步骤2中产生的气体通入品红溶液 |
品红溶液褪色 |
|
写出卓玛同学实验过程中的化学方程式: , 。
小吴对化学实验有浓厚的兴趣,设计了如下实验装置进行实验,按要求填空.

①仪器a的名称 ;可用于实验室制取O2的发生装置有 (填装置编号,下同);实验室制取CO2的发生装置有 ;用C装置收集CO2时,气体应从C装置的 端进入(填“b”或“c”).
②实验室制取H2的化学方程式为 .
③小吴D装置的溶液中滴入石蕊试液,发现溶液显蓝色,由此可知碳酸钠溶液呈 性(填“酸”、“碱”或“中”).
④小吴用E装置探究CO2能否与碳酸钠溶液反应,他做了两组对比实验:第一组用胶头滴管向广口瓶中加入2 mL水,发现气球鼓起不明显;第二组用胶头滴管广口瓶中加入2 mL一定质量分数的碳酸钠溶液,发现气球迅速鼓起.他得出的结论是:CO2能与碳酸钠溶液反应,该反应的化学方程式为 .