"秸秆变宝,助力脱贫攻坚"。秸秆用于制沼气可以解决农村的燃料短缺问题。沼气的主要成分是CH 4,可能含有CO 2、CO。小霞与小明采集了某沼气池中的气体样品,探究该沼气中是否含有CO 2和CO。
【查阅资料】①CH 4+4CuO  4Cu+CO 2+2H 2O;CuO+CO
4Cu+CO 2+2H 2O;CuO+CO  Cu+CO 2②CH 4、CO均不与碱溶液、浓硫酸发生反应③CO 2不与浓硫酸反应
Cu+CO 2②CH 4、CO均不与碱溶液、浓硫酸发生反应③CO 2不与浓硫酸反应
【设计实验】小霞与小明设计并进行了如图所示的实验。(装置气密性良好;忽略装置内空气中的水蒸气)

(1)为确保实验的安全性,小霞和小明一致认为:实验前要先通一会儿气体样品,然后再点燃D处的酒精灯,其目的是 。用装置F收集尾气,导管口的连接顺序是a接 (填"b"或"c")。
(2)小霞想通过装置D中固体减少的质量(即参加反应的CuO中氧元素的质量)和装置E增加的质量来判断混合气休中是否含有CO。小明表示同意并提出:停止加热后,要继续通入一会儿气体样品,以排出装置D内残留的反应生成的气体。
【现象与结论】(1)观察到装置A中的澄清石灰水变浑浊,说明沼气中含有 。
(2)反应结束后,测得装置D中固体减少的质量是3.2g,装置E增加的质量是1.8g。说明沼气中 (填"含"或"不含")CO。
【拓展与延伸】秸杆不仅可制沼气,还可以造出板材制作家具。对比焚烧秸秆,这样做的意义在于 (答一条即可)。
(9分)某化学兴趣小组的同学将一枚洁净的铁钉放入食盐水中(如图,装置气密性良好),一段时间后,进行观察。请你一起参与分析,并完成后续实验设计。
【观察现象】①装置中右侧导管中的液面升高。
②铁钉生锈,试管底部有黑色固体物质。
【提出问题】导管中液体为何升高?黑色固体物质又是什么?
【理论分析】小组同学根据已学过的知识分析得知,液面上升的原因是_______________。
【猜想与假设】小组中的小明同学猜测该黑色固体可能含有:①________,②Fe2O3,③FeCl3,④C四种物质。
【分析与验证】小组同学根据小明的四种猜测做了以下分析:
(1)小红同学认为不可能含有氯化铁,该结论得到小组同学的认可,理由是_______________。
(2)小强同学想证明是否含有碳,他设计了下列方案并进行实验:
| 实验步骤 |
实验现象 |
实验结论 |
| 用试管取少量黑色固体,滴加足量稀盐酸一定含有碳 |
(3)小组同学不能确定是否含有铁,请你帮他们设计方案进行确认:
| 实验步骤 |
实验现象 |
实验结论 |
| 你选用的试剂是:________ |
【知识链接】相信你一定在家中做过铁钉分别在水以及食盐水中生锈的实验,你的结论之一是铁钉在________(填“水”或“食盐水”)中生锈快。
【反思】防止铁制品生锈的方法是________________(写一种)。
铁、铝、铜是常见的三种金属。同学们发现生活中的铝和铜制品表面一般不用防锈,而铁制品一般需要做防锈处理。
【提出问题】这是不是因为铁、铝、铜三种金属中铁的活动性最强呢?
【实验探究】同学们对这三种金属的活动性顺序展开了探究,请你参与探究并填写空格。
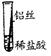
将粗细相同的铁丝、铝丝、铜丝分别插入体积相同、溶质质量分数也相同的稀盐酸中:
| 操作 |
 |
 |
 |
根据现象得出金属活动性顺序 |
| 片刻后现象 |
有少量气泡 |
无气泡 |
无气泡 |
Fe>Al,Fe>Cu |
| 几分钟后现象 |
有少量气泡 |
有大量气泡 |
无气泡 |
【讨论交流】为什么同一个实验得出了两种结论呢?同学们带着这个疑问查阅了相关资料,明白了铝丝在稀盐酸中短时间内无气泡,是因为铝表面致密的氧化膜会先与盐酸反应。
【反思评价】做金属性质实验时需将金属进行打磨,打磨的目的是
。
【实验验证】为了进一步确认铁、铝、铜这三种金属的活动性顺序,同学们又将两根粗细相同的、打磨过的铁丝分别插入硫酸铝溶液、硫酸铜溶液中:
| 操作 |
 |
 |
根据现象得出金属活动性顺序 |
| 现象 |
无明显现象 |
Al>Fe>Cu |
写出铁与硫酸铜溶液反应的化学方程式。
【拓展迁移】(1)若只有一支盛有少量稀盐酸的试管,只需合理安排金属丝的插入顺序(能与盐酸反应的要一次将盐酸消耗完),也能证明铁、铝、铜这三种金属的活动性顺序。金属丝的插入顺序为。
(2)金属被人类大规模开发利用的大致年限也与金属活动性顺序有关,请写出铁、铝、铜三种金属材料被人类利用的先后顺序。
同学们对
是否支持常见金属的燃烧进行了如下探究活动:
【活动一】探究
是否支持实验室常见金属镁的燃烧
实验①:将燃着的镁条插入充满
的集气瓶中,发现镁条仍在燃烧.观察生成物,除白色物质外,还有黑色物质.
(1)镁在
中反应的化学方程式为.
(2)实验①的结论是,由该结论可知(写"能"或"不能")用
灭火器扑灭活泼金属的火灾.
(3)通过实验①你对燃烧条件的新认识是.
【活动二】探究
是否支持生活中常见金属铁的燃烧
实验②:将弯成螺旋状的细铁丝系上一支火柴,点燃火柴后立即将铁丝插入装有
的集气瓶中,发现铁丝未燃烧.
某同学提出:如果实验②中细铁丝未得到充分加热,将对判断"
是否支持铁的燃烧"造成干扰.他依据什么认为实验②中细铁丝未得到充分加热
请你帮助他设计对比实验,排除干扰因素,证明
是否支持铁的燃烧.
| 实验方法 |
可能观察到的现象和结论 |
| 如果铁丝在装
和装
的集气瓶中都燃烧,证明
支持铁的燃烧 |
|
| 如果铁丝在装
的集气瓶中燃烧,在装
的集气瓶中逐渐冷却,证明
不支持铁的燃烧 |
科学探究是奇妙的过程,请你一起参与实验探究,并填写下列空白:
(1)[提出问题]小松同学用“双氧水”(过氧化氢溶液)清洗伤口时,不小心将过氧化氢溶液滴到水泥地板上,发现有大量气泡产生。小松联想到自己曾经用二氧化锰做过氧化氢分解的催化剂,他想,水泥块能否也可作过氧化氢分解的催化剂呢?于是他到附近建筑工地取回一些小水泥块,并用蒸馏水浸泡、冲洗、干燥,并进行以下探究。
(2)[猜想]水泥块能作过氧化氢分解的催化剂。
(3)[实验验证]
| 实验步骤 |
实验现象 |
实验结论 |
|
| 实验一 |
木条不复燃 |
常温下过氧化氢溶液不分解 |
|
| 实验二 |
在装有过氧化氢溶液的试管中加入水泥块,然后将带火星的木条伸入试管中 |
木条复燃 |
(4)[结论]水泥块能加快过氧化氢的分解速率,故水泥块能作过氧化氢分解的催化剂。
(5)[讨论与反思]小芳认为:仅凭上述两个实验还不能证明水泥块为过氧化氢分解的催化剂,她觉得需要增加一个探究实验:探究
[实验步骤]①准确称量水泥块的质量;②完成实验二;③待反应结束,将实验二试管里的物质进行过滤,洗涤,,;
④对比反应前后水泥块质量。
[分析]如果水泥块反应前后质量不变,则说明水泥块可以作过氧化氢分解的催化剂。
(6)但小华认为,要证明小松的猜想,小芳的补充实验还是不足够,还需要再补充一个探究实验:探究。
某兴趣小组在学习碱的化学性质时,进行了如图所示的实验。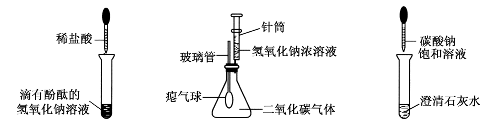
甲乙丙
(1)写出甲实验中盐酸和氢氧化钠反应的化学方程式。
(2)乙实验中滴加氢氧化钠溶液后,可观察到的现象是。
(3)丙实验中观察到试管内有白色沉淀产生。
(4)实验结束后,同学们将甲、乙、丙三个实验的废液倒人同一个子净的废液缸中,最终看到废液浑浊并呈红色,由此产生疑问。
【提出问题】废液中含有哪些物质?
【交流讨论】①一定含有的物质:碳酸钙、指示剂、水和。
②还含有能使废液呈碱性的物质。能使废液呈碱性的物质是什么?同学们有如下猜想。
小兰认为:只有碳酸钠
小刚认为:只有氢氧化钙
小亮认为:是氢氧化钠和碳酸钠
你认为还可能是。(写一种猜想)
【实验设计】小斌想用氯化钙溶液来验证小兰、小刚、小亮的猜想。查阅资料获悉氯化钙溶液呈中性,并设计如下实验。请你将小斌的实验设计补充完整。
| 实验内容 |
预计现象 |
预计结论 |
| 取少量废液缸中上层清液于试管中,加入过量氯化钙溶液,静置。 |
①有白色沉淀,溶液呈红色。 |
的猜想正确。 |
| ② |
的猜想正确。 |
|
| ③ |
的猜想正确。 |
【反思拓展】在分析化学反应后所得物质的成分时,除了考虑生成物外还需考虑
。