以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵[(NH4)3Fe(C6H5O7)2].
(1)Fe基态核外电子排布式为 ;[Fe(H2O)6]2+中与Fe2+配位的原子是 (填元素符号).
(2)NH3分子中氮原子的轨道杂化类型是 ;C、N、O元素的第一电离能由大到小的顺序为 .
(3)与NH4+互为等电子体的一种分子为 (填化学式).
(4)柠檬酸的结构简式如图.1mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为 mol.

(共12分)
MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如下:
(1)第①步加稀H2SO4时,粗MnO2样品中的(写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式是
□+ □ClO3— + □= □MnO2↓ + □Cl2↑ + □。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、酒精灯、、。
已知蒸发得到的固体中含有NaClO3和NaOH,则一定还含有(写化学式)。
(4)用浓硫酸来配制本实验需要的稀硫酸,进行如下操作,其中会使所配溶液浓度偏高的是
A用量筒量取浓硫酸倒入小烧杯后,用蒸馏水洗涤量筒并将洗涤液转移到小烧杯中
B定容时仰视
C用量筒量取浓硫酸时,读数时仰视
D容量瓶中有水,未进行干燥
(5)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO2,并收集到0.224L CO2(标准状况下),则在第②步反应中至少需要mol NaClO3。
二氯化硫(SCl2)熔点-78℃,沸点59℃。密度1.638 g·cm-3,遇水易分解,是一种重要的化工试剂,下图是氯气与硫在50~59℃时合成二氯化硫的实验装置。
(1)装置A中发生反应的化学方程式为:。
(2)装置B盛放的药品是,作用是;装置C盛放的药品是,作用是。
(3)实验开始前先在D中放入一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁表面形成一薄层,这样做的目的是。
(4)F装置中干燥管内所盛物质是,一个作用是,还有一个作用是。
海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义.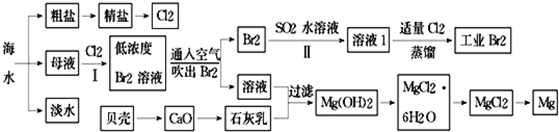
(1)氯碱工业主要以食盐为原料.为了除去粗盐中的Ca2+、Mg2+、SO42﹣及泥沙,可将粗盐溶于水,然后进行下列操作,正确的操作顺序是.
①过滤;
②加过量的NaOH溶液;
③加适量的盐酸;
④加过量的Na2CO3溶液;
⑤加过量的BaCl2溶液.
a.②⑤④①③b.①④②⑤③c.④②⑤③①d.⑤②④①③
(2)在实验室中可以用萃取的方法提取溴,可选用的试剂是,所用主要仪器的名称是.
(3)步骤Ⅰ中用硫酸酸化可提高Cl2利用率的原因是.
(4)步骤Ⅱ反应的离子方程式.
(5)海水提溴蒸馏过程中,温度应控制在80~90℃,温度过高或过低都不利于生产,请解释原因.
(6)Mg(OH)2沉淀中混有Ca(OH)2,可选用溶液进行洗涤除去.如直接加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,你(选填“同意”,“不同意”)该说法,理由是.
小刚同学探究二氧化硫分别与BaCl2溶液、Ba(OH)2溶液反应的实验.请回答有关问题.
(1)少量SO2通入到Ba(OH)2溶液中的离子反应方程式为,过量的SO2通入到Ba(OH)2溶液中的离子反应方程式为.
(2)小刚同学将SO2通入到BaCl2溶液中,出现了异常现象,看到了明显的白色沉淀,为探究该白色沉淀的成分,他设计了如下实验流程:
则操作①的名称为,试剂A的化学式为.
(3)实验表明,小刚加入试剂A后,白色沉淀未见溶解,则该白色沉淀的成分是(填化学式),试推测产生该白色沉淀的离子方程式是.
(8分)某同学用某种粗盐进行提纯实验,步骤见下图。请回答下列问题: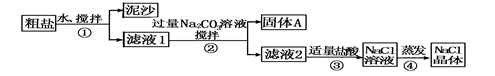
(1)步骤①和④的操作名称分别是,。
(2)步骤③判断加入盐酸“适量”的方法是。
(3)猜想和验证:(并完成相应填空)
| 猜想 |
验证的方法 |
现象 |
结论 |
| 猜想Ⅰ:固体A中含CaCO3、MgCO3 |
取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 |
__________ |
猜想Ⅰ成立 |
| 猜想Ⅱ:固体A中含BaCO3 |
取少量固体A于试管中,先滴入________,再滴入Na2SO4溶液 |
有气泡放出,无白色沉淀 |
______ |
| 猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 |
取少量NaCl晶体溶于试管中的蒸馏水, |
__________ |
猜想Ⅲ成立 |